基本信息
1、办理部门:重庆市药品监督管理局
2、办理方式:窗口办理 网上办理 快递申请
3、办理地点:重庆市渝北区宝圣湖街道食品城大道27号重庆市药品监督管理局行政审批服务中心05-09号窗口
4、咨询电话:023-60353664 CIO咨询:400-003-0818
受理条件
1、市场上已有供应的品种。
2、医疗机构制剂批准文号的有效期为3年,有效期届满需要继续配制的,申请人应当在有效期届满前3个月提出再注册申请,报送有关资料。
3、按照《医疗机构制剂注册管理办法(试行)》(国家食品药品监督管理局令第20号)应予撤销批准文号的。
4、未在规定时间内提出再注册申请的。
5、办理医疗机构制剂再注册申请事务的人员应当是相应的专业技术人员,并且应当熟悉相关管理法律、法规和医疗机构制剂注册的技术要求。
6、其他不符合规定的。
7、其他不符合规定的医疗机构制剂再注册的申请人,应当是持有《医疗机构执业许可证》、有相应诊疗科目,并取得《医疗机构制剂注册批件》或制剂批准文号的医疗机构。
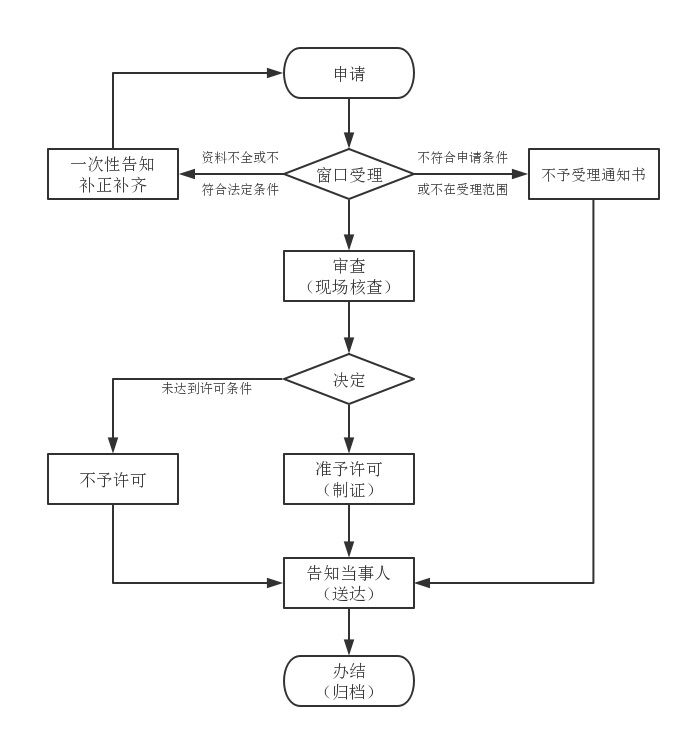
办理流程
流程文字说明
法定办理时限:30个工作日;承诺办理时限:15个工作日
1、受理(时限:0个工作日)
2、审查(时限:10个工作日)
3、决定(时限:5个工作日)
4、颁证(时限:0个工作日)
申请材料
1、证明性文件;
2、申报资料真实性承诺书;
3、上次批准再注册以来制剂临床使用情况及不良反应情况总结;
4、配制制剂所用原辅料的来源;
5、医疗机构制剂再注册申请表;
6、现行说明书、标签实样一份;
7、工艺、处方和质量标准。
结果样本
常见问题
问题1:1.3年内制剂临床使用情况及不良反应情况总结应包含哪些内容? (1)每年的配制量、每年处方量、每年病例数及临床疗效小结等; (2)临床使用中不良反应情况的总结。 (3)接受食药监部门检查的情况。如:抽检的批次及结果,针对抽检不合格的情况如何处理等。 2.制剂处方、工艺、质量标准,以及关于制剂处方、工艺、质量标准的执行情况和存在问题的说明应包含哪些内容?
答:(1)制剂的处方、工艺、质量标准等原则上应于批准时一致,如有变化,应按变更批准时间列出历次变更项目及内容,并提供补充申请批件。 (2)配制工艺规程应具体描述每个单元操作过程,明确制备工艺中的主要技术参数(如温度、压力、相对密度、出粉率、出膏率、灭菌方法等)。鉴于制药技术和设备的发展更新,在不改变其物质基础的前提下,变更浓缩、过滤、制粒、包装等所用设备的,应当提供变更前后的制剂质量对比试验资料。
本办事指南摘自药监局官网,如有变动,以官方发布为准。























