 E邀专家
E邀专家
1项严重缺陷+6项主要缺陷!广东一药企被罚15万元背后的系统性管理危机
CIO专家-乌木
近日,广东一家药品经营企业因在监督检查中被发现存在1项严重缺陷及6项主要缺陷,被处以15万元罚款的行政处罚。
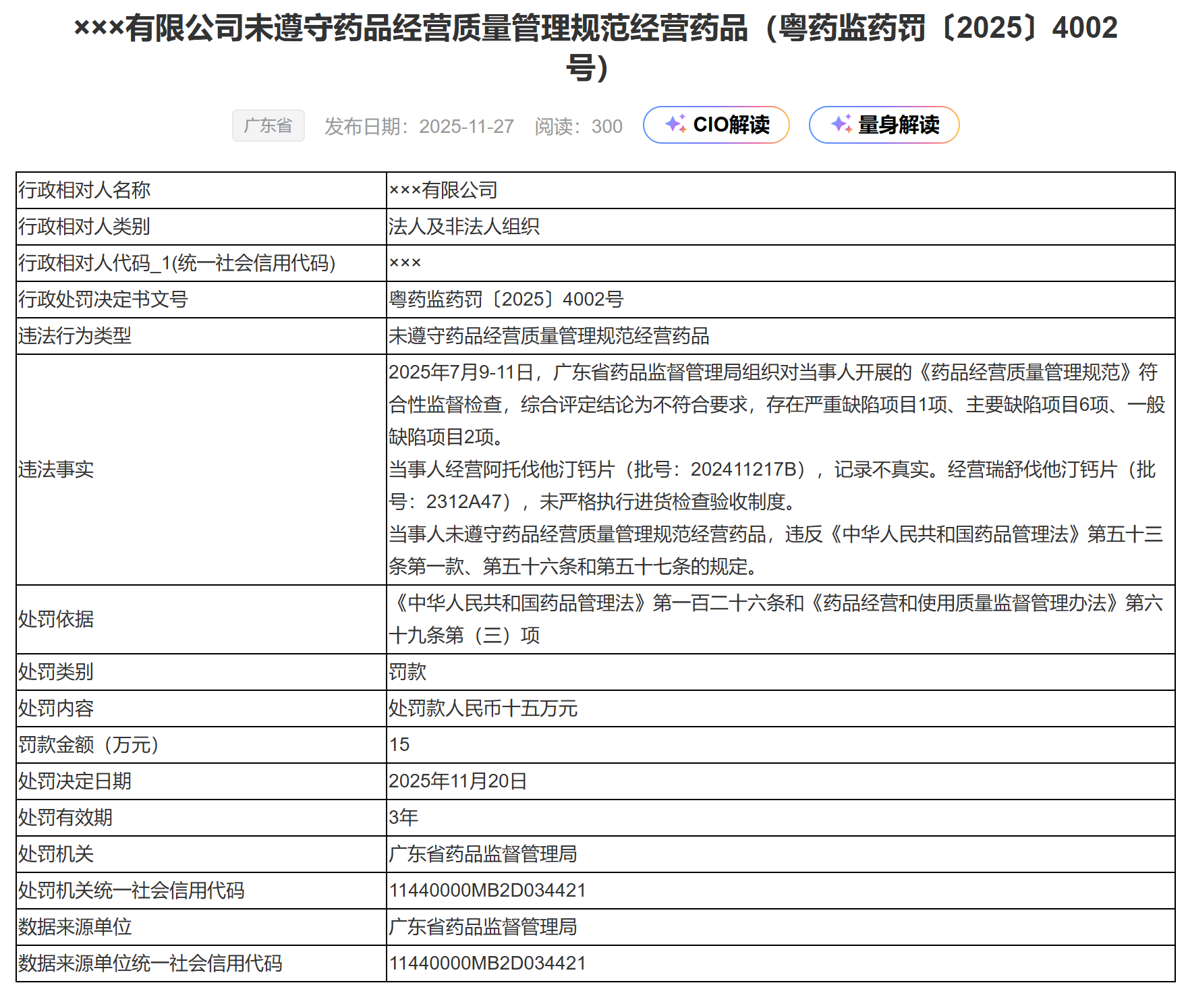
这一案例并非个例,它清晰地揭示出一个普遍而危险的倾向:在许多药企内部,经营业绩的短期压力已严重挤压了质量管理体系应有的空间,导致合规防线形同虚设,系统性风险不断累积。
一、违规表象之下:是质量管理体系的“系统性塌方”
此次查处的缺陷,表面上是具体操作的失范,如经营记录造假、验收制度不执行、追溯记录不真实等。然而,这些孤立问题的同时出现,绝非偶然。它们共同指向一个更深层的核心问题:企业内部的质量管理体系已陷入“空转”状态,失去了对业务活动的有效监督和控制力。
1、流程脱节:GSP本应是一个由采购、验收、仓储、养护、销售、运输及质量管理等多环节紧密咬合的精密链条。但在“重经营、轻管理”的导向下,这些环节往往各自为政。例如,采购部门为追求低价或效率,可能从资质存疑的渠道进货;而验收环节或为“配合业务”流于形式,或缺乏足够的能力与权威去拦截问题产品。链条从起点就已断裂。
2、责任模糊:当质量出了问题,往往难以追溯到具体的责任岗位。是验收员未尽责?是质量负责人监督不力?还是管理层默许了违规操作?责任体系的模糊,使得违规成本个人化、风险承担集体化,进一步鼓励了侥幸心理。
二、核心风险:追溯失灵与验收失效的致命组合
案例中暴露的追溯记录不真实与验收防线失效,是GSP体系中最致命的“双杀”组合。
1、追溯失灵:药品“从哪来、到哪去”的轨迹一旦无法真实、完整记录,企业就丧失了风险控制的基本能力。一旦发生药品安全事件,无法实施精准召回,公众健康将暴露于巨大风险之中,企业也将面临毁灭性的法律责任和声誉损失。
2、验收失效:验收是药品流入企业前的最后一道,也是最重要的质量关卡。这道关卡的失守,意味着企业主动放弃了对其经营产品质量的源头控制,等同于对不明来源或不合格药品敞开了大门。后续的所有仓储、养护、销售活动都建立在虚假的安全基础之上。
这两者结合,使得企业的经营行为如同“盲人骑瞎马”,风险极高且完全不可控。
三、根本出路:构建常态化自查与有效制衡的治理结构
监管处罚是外部的纠正与警示,但企业长治久安的根本在于内部的自我修复与持续改进能力。为此,必须实现两个关键转变:
1、从“应对检查”到“常态化自查”:企业必须建立并运行一套定期、深入、覆盖全流程的內部质量审计制度。这套制度不应是应付检查的摆设,而应是管理层的“眼睛”和“耳朵”,主动、持续地发现体系运行的薄弱环节和潜在风险,并将其消灭在萌芽状态。
2、从“责任模糊”到“有效制衡”:必须明确建立并严格执行权责清晰的岗位责任制,尤其是赋予质量管理部门独立的监督权、否决权。质量管理部门不能依附于业务部门,而应作为关键的制衡力量,确保任何业务决策和操作都必须在质量安全的框架内进行。管理层必须以实际行动支持这种制衡,将质量KPI与业务KPI置于同等甚至更为优先的地位。
结语
15万元的罚单,是对过去错误的清算,更是对未来经营的预警。
它告诫所有药品经营企业:在强监管时代,任何对质量管理体系的轻视与削弱,都是在为企业埋下“定时炸弹”。唯有将GSP要求真正融入企业血液,建立权责清晰、流程严谨、有效制衡的内部治理结构,才能将合规从“成本负担”转化为企业最核心的可持续竞争力,在确保公众用药安全的同时,实现自身的稳健与长远发展。
 E邀专家
E邀专家






















