基本信息
1. 办理部门:广东省药品监督管理局
2. 办理方式:网上办理
3. 办理地点:广州市黄花岗街道东风东路753号之二一楼受理大厅
4. 药监咨询:020-37886014 CIO咨询:400-003-0818
受理条件
1. 企业注册地在广东省内;
2. 符合食药监办械注〔2015〕511号文中第四条要求,且能提供食药监办械注〔2015〕511号文中第五条材料的。
办理流程
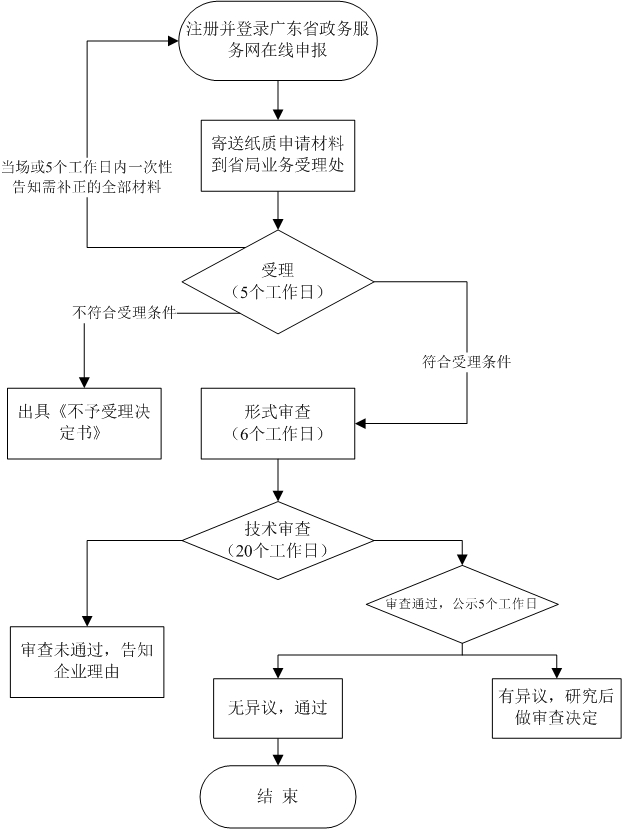
流程文字说明
法定办结时限:26个工作日;承诺办结时限:26个工作日。
申请:
实行无纸化申报,可登录广东省政务服务网进行网上申报工作,填报申请事项材料,证明材料以扫描件上传。所有申报资料内容必须真实、合法,文字、图案清楚;电子扫描件需加盖申请人印章,为pdf扫描件,每个文件大小不能超过10M,按照系统要求上传至办事平台。
资料接收:
受理大厅收到申请材料后,作出资料接收或不予接收决定。申请材料不齐全或者不符合法定形式的,当场或者在5日内一次告知申请人需要补正的全部内容,逾期不告知的,自收到申请材料之日起即为受理。
受理:
实施机关对申请资料进行形式审查。申请被受理的,申请人可获得实施机关出具的受理凭证;申请不被受理的,申请人可获得实施机关出具的不予受理通知书,不予受理通知书的内容包括不予受理的理由。
获取结果:
申请人可登录广东省药品监督管理局公众网首页审批查询栏进行办理进度查询,登录企业申报端获取电子证书。
申请材料
1. 广东省创新医疗器械特别审批申请表;>>广东省创新医疗器械特别审批申请表
2. 产品知识产权情况及证明文;
3. 营业执照;
4. 产品作为第二类医疗器械管理的分类依据;
5. 产品研发过程及结果的综述,产品技术文件;
6. 产品说明书(样稿);
7. 体现临床应用价值的资料。
结果样本


常见问题
问题1:什么器械产品可以申请第二类创新医疗器械特别审批程?
答:广东省药品监督管理局对同时符合下列情形的医疗器械按本程序实施特别审批: (1)申报产品为第二类医疗器械,申请人属于我省辖区,申报产品拟由申请人生产。 (2)申报产品拥有如下知识产权或获奖证明之一: ①国家级发明奖、科技进步奖; ②省级科技进步奖二等奖以上; ③市级科技进步奖一等奖; ④核心技术发明专利; ⑤实用新型专利(与临床应用相关)。 (3)申报产品具有显著的临床应用价值,产品技术为国内领先,或可填补省内该品种医疗器械的空白,或可替代同类进口产品。 (4)申请人已完成申报产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
问题2:第二类创新医疗器械特别审批程序是什么?
答:请参照《广东省第二类创新医疗器械特别审批程序(试行)》(链接:http://mpa.gd.gov.cn/zwgk/gzwj/content/post_1841813.html)。
问题3:创新医疗器械申请前是否可以现场咨询?如何申请?是否需要预约,通过什么渠道预约?
答:请向广东省药品监督管理局审评认证中心提出受理前技术问题咨询(参考链接:http://www.gdcec.org.cn/spzx/tzgg/content/post_178385.html)。
问题4:创新医疗器械特别审批是否适用免临床试验产品注册?
答:一般而言,创新医疗器械在技术原理或预期用途等方面,显著有别于常规产品,因此需要开展临床试验予以确认。但也应具体情况具体分析,请比对与所述“新增免临床产品”的异同点。
问题5:广东省第二类创新医疗器械特别审查申请表最后的“申请资料”部分,请问内容填写有具体要求吗?
答:没有特别要求,可填写整理总结后的核心内容。
本办事指南摘自药监局官网,如有变动,以官方发布为准。