 E邀专家
E邀专家
欧美日及中国原料药管理制度介绍
CIO专家-丹参
欧美日及中国原料药管理制度介绍
原料药在ICH Q7A中的定义为用于药品制造中的任何一种物质或物质的混合物,而且在用于制药时,成为药品的一种活性成分。此种物质在疾病的诊断,治疗,症状缓解,处理或疾病的预防中有药理活性或其他直接作用,或者能影响机体的功能或结构。
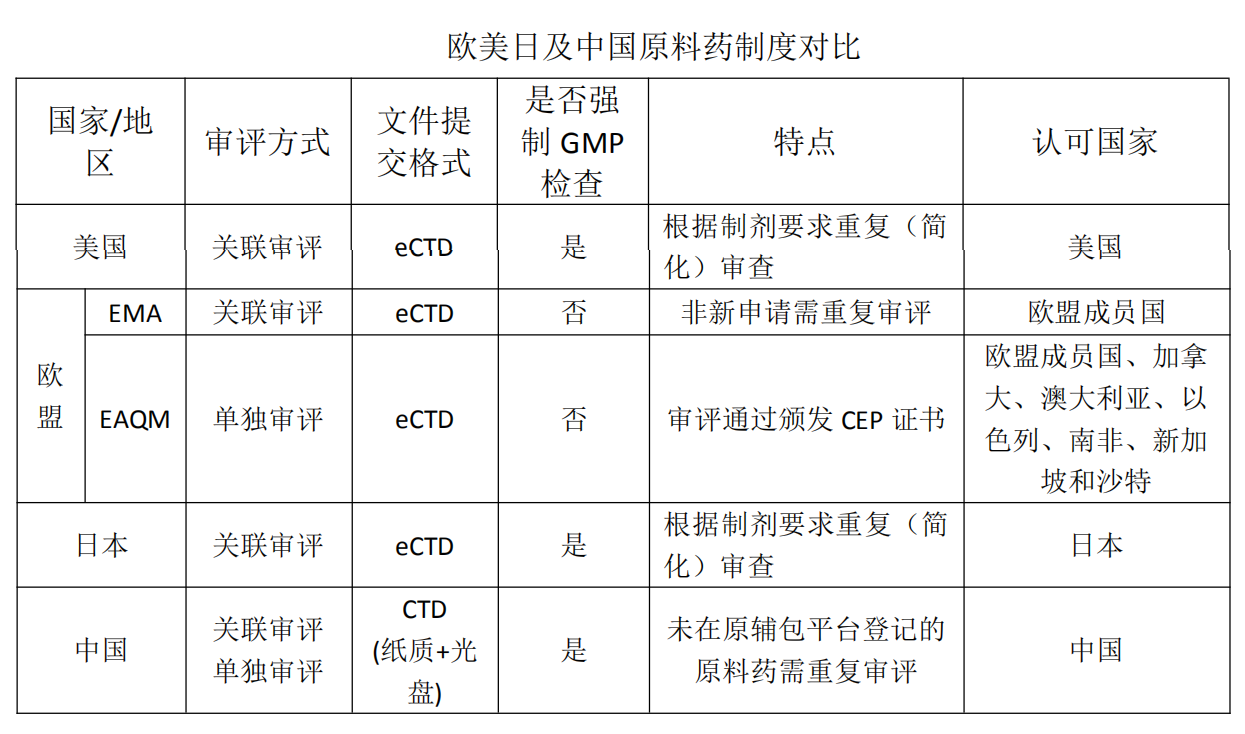
目前药品发达国家大部分实行原料药登记管理制度。为了与国际制药行业接轨,我国在2017年11月30日(2017年第146号公告)开始实施原料药登记管理及关联审评审评制度,又于2019年7月16日发布了《国家药监局关于进一步完善药品关联审评审批和监管工作有关事宜的公告》(2019年第56号),明确了仿制药原料药可以进行单独审评审批,标志着我国原料药的管理步入一个具有中国特色的新时代。本文将总结和对比欧美日及中国的原料药管理制度,为原料药注册人员提供帮助。
一、美国原料药管理制度
美国原料药实行药物注册文件(DMF)登记管理制度,FDA对原料药不进行单独的审评审批,也不会批准或不批准DMF,只有制剂申请人才能激活原料药的审评程序。申请人编写完DMF后提交到FDA,FDA对DMF实行三个阶段的审核,即行政审核、付费审核及技术审核。行政审核阶段类似于我国的形式审查,目的是为了确认申请人行政信息的完整性,通过审查后FDA会分配一个DMF登记号,且标记为活动状态(Active),申请人必须提交年报才能维持活动状态。付费审核阶段类似于我国的立卷审查,目的是为了确认申请人提交的DMF符合技术审核的要求,通过审核后,FDA会将其收录到DMF用户付费责任报告之中,然后用于仿制药的关联审评。技术审核阶段类似于我国的正式审评阶段,他对制剂及原辅料进行全面的审评审评,目的是为了保证药品安全、有效,质量可控。
二、欧盟原料药的注册管理制度
原料药在欧盟的注册管理方式主要是欧洲药典专论适用性证书(CEP或COS)程序、活性物质主文件(ASMF或EDMF)程序以及ASMF评估工作共享程序。
欧洲药典专论适用性证书程序适用于欧洲药典收载的品种,由欧洲药品质量管理局(EDQM)组织专家对提交资料进行审评并颁发欧洲药典专论适用性证书,目的是为了减少大量的重复审评工作,他是原料药厂商进入欧洲市场的首选程序。
ASMF程序适用于原料药不在欧洲药典或任何一个成员国药典中,或者该原料药在欧洲药典或成员国药典中但使用了新的质量控制标准。该程序由欧盟单个国家的药品监管机构负责审评的,需要与制剂上市许可申请人的申请文件一起进行评审,文件分为公开部分(AP)和保密部分(RP)。无论ASMF是否已经登记过,都要进行重新提交和审评,且不同国家的审评机构会有不同的侧重,甚至会得出不同的审评结论。
ASMF评估工作共享程序是欧洲药品管理局为了节约审评资源,提高审评效率,弥补ASMF程序的不足提出的审评程序。ASMF评估工作共享程序主要适用于支持欧盟药品制剂上市许可申请的新的ASMF,即该ASMF在欧盟范围内无审评记录,对受理的ASMF分配独立的ASMF号,并录入欧盟ASMF编码系统。
ASMF评估工作共享程序并不能解决那些在欧洲范围内有审评记录,且没有被欧洲药典收录的原料药的重复审评问题,这些原料药注册依然要走ASMF程序。
三、日本原料药管理制度
日本PMDA从2005年开始,原料药实行MF(Master File)登记管理制度。MF分为公开部分和非公开部分,日本国外的原料药厂商必须指定一个日本管理人进行登记。在MF登记时,PMDA仅做形式上检查,不对其内容进行审评。只有在制剂申请上市许可时,才会启动对该原料药的审评程序。当制剂获得上市许可以后,同剂型同用途的其他制剂引用该MF申请上市许可时,PMDA对该MF的审查可以简略化,提高了审查效率。如果是用于不同剂型或不同用途的制剂申请,PMDA会围绕该制剂的用途和功效重新对MF注册内容的妥当性进行审查。
四、中国原料药管理制度
中国国家食品药品监督管理总局关于调整原料药、药用辅料和药包材审评审批事项的公告(2017年第146号)指出,自2017年11月30日公告发布之日起,药品注册申请人在中华人民共和国境内提出的注册分类2.2,2.3,2.4,3,4,5类(非新原料药)药品制剂申请所使用的原料药,在审批药品制剂注册申请时一并审评审批。而在2020年7月1日实施的《药品注册管理办法》第四十三条中规定:仿制境内已上市药品所用的化学原料药的,可以申请单独审评审批。因此,目前中国的原料药管理制度有关联审评和单独审评两种,它吸取了欧盟EMA和EDQM原料药管理制度的优点,结合目前中国原料药企业面临的境况,形成了中国特色的原料药管理制度,符合中国制药行业现阶段的发展需求。
 E邀专家
E邀专家






















