 E邀专家
E邀专家
聚焦全国两会,全国人大代表、人福医药董事长李杰提出,由于新药研发的成功率非常低,为了激励新药研发,防止仿制药直接引用原研药试验数据,保护药品研发知识产权,《药品试验数据保护制度》亟待完善。
据了解,很多发达国家和地区为保护药品研发企业在上市许可过程中所提交的试验数据,建立了药品试验数据保护制度,对不同类型的药品给予相应的保护期。
目前,我国除了国家药品监督管理局在2018年4月发布的《药品试验数据保护实施办法(暂行)(征求意见稿)》外,尚没有相关配套规章制度出台。
一、什么是药品试验数据?
药品试验数据,指药品上市申请人根据要求所提交的药品上市注册申请文件数据包中与药品有效性相关的非临床和临床试验数据。
二、药品实验数据保护制度任存在什么问题?
1、世界范围内尚未形成统一的药品试验数据保护标准。
2、试验数据保护申请是获得药品试验数据保护的必要条件吗?
3、首仿药是否适用于数据独占的保护方式?
4、享有试验数据保护的药品的仿制药申请何时可以获批,是期满前或期满后?
5、保护的试验数据要求是未披露过的数据吗?
三、我国现行的药品试验数据制度
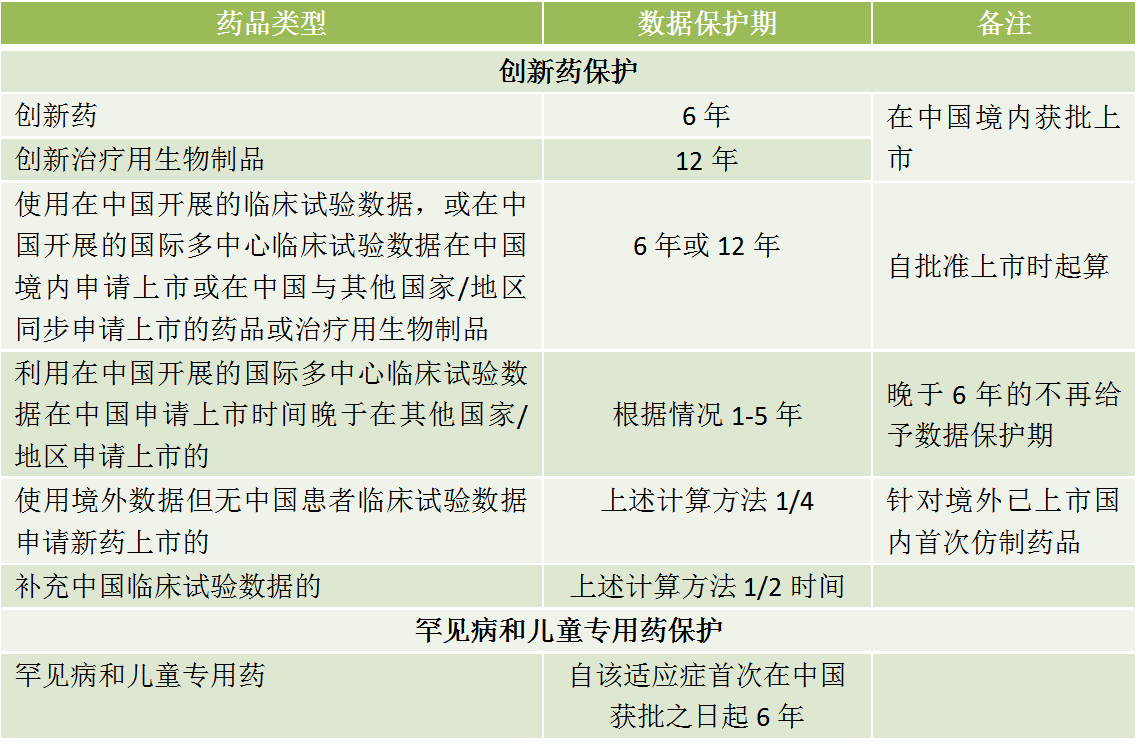
2018年4月26日,药监局公布的《药品试验数据保护实施办法(暂行)(征求意见稿)》,针对不同的药品类型给予不同的数据保护期,但是未提及监管机制和法律后果。
1、不包括对改良型创新药和改良型生物制品。
2、仿制药仅提交有关生物等效性的试验数据。
3、药品安全性相关的数据没有纳入“药品试验数据”受保护范围。
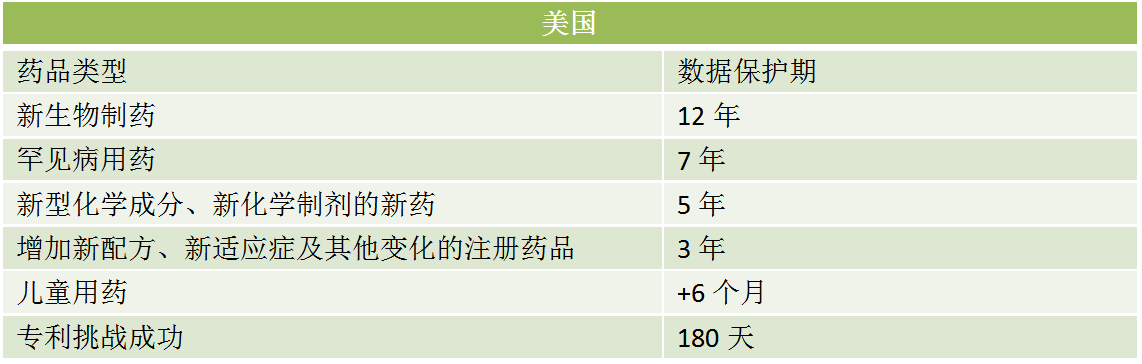
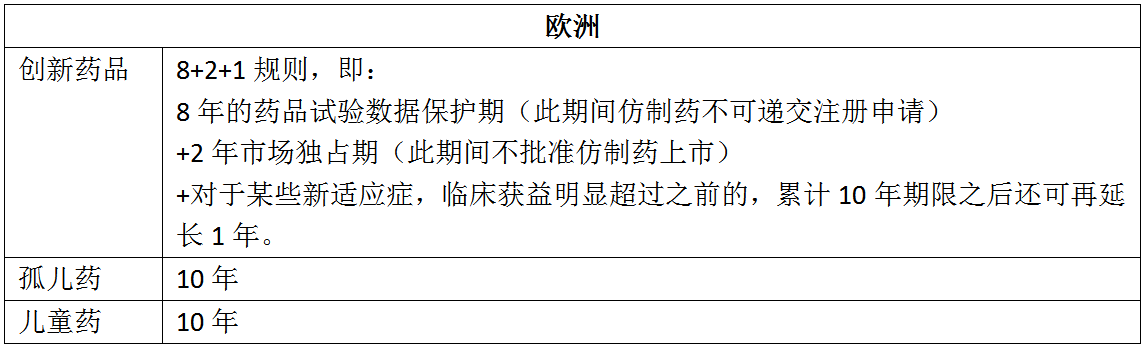
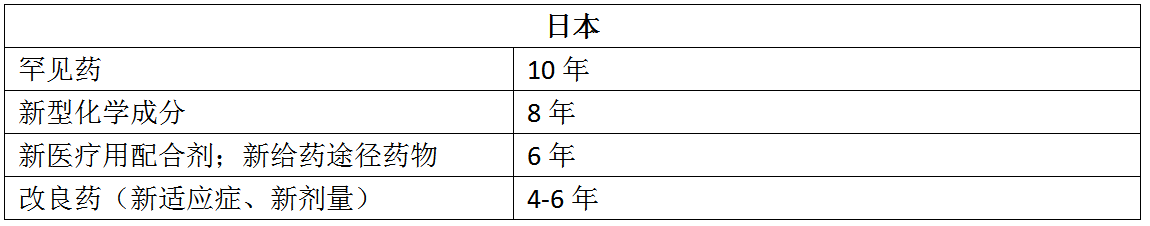
四、对比美国、欧洲和日本
以欧洲为例,对儿童药、孤儿药给予了10年的保护期,对创新药品给予了8年的保护期加上2年的市场独占期。该项制度的实施,基本可避免仿制药直接引用原研药试验数据的现象,对保护药品研发成果,促进药品创新,推动医药产业发展具有重要意义。
五、展望
随着我国医药产业的快速发展,对创新药、创新生物制品、儿童药、罕见病用药等药品给予试验数据独占保护的时机已基本成熟。在《药品试验数据实施条例(暂行)》征求意见稿之际,我们应当对该制度进行完善,如明确我国的立法模式,清楚界定保护范围,明确保护限制,制定实施细则,切实增强药品试验数据保护制度的可操作性,最终实现知识产权保护与公共健康平衡的目的。
相关文件下载、服务及学习课程:
合规文库:药品注册管理办法(2020年)
合规培训:药品注册必备知识点
合规服务:药品注册申请
联系专家,获取专家指导意见:e邀专家
 E邀专家
E邀专家























