基本信息
1. 办理部门:广东省药品监督管理局
2. 办理方式:网上办理,快递申请
3. 办理地点:广州市黄花岗街道东风东路753号之二一楼受理大厅
4. 药监咨询:020-37886014 CIO咨询:400-003-0818
受理条件
符合以下全部条件的医疗机构可以提出申请:
1、持有医疗机构执业许可证书并取得具对应配制范围的《医疗机构制剂许可证》的医疗机构;
2、应符合《医疗机构制剂注册管理办法(试行)》第十四条规定;
3、未取得《医疗机构制剂许可证》或无对应配制范围的医院可以申请中药制剂注册,在申请配制时同时提出委托配制的申请。
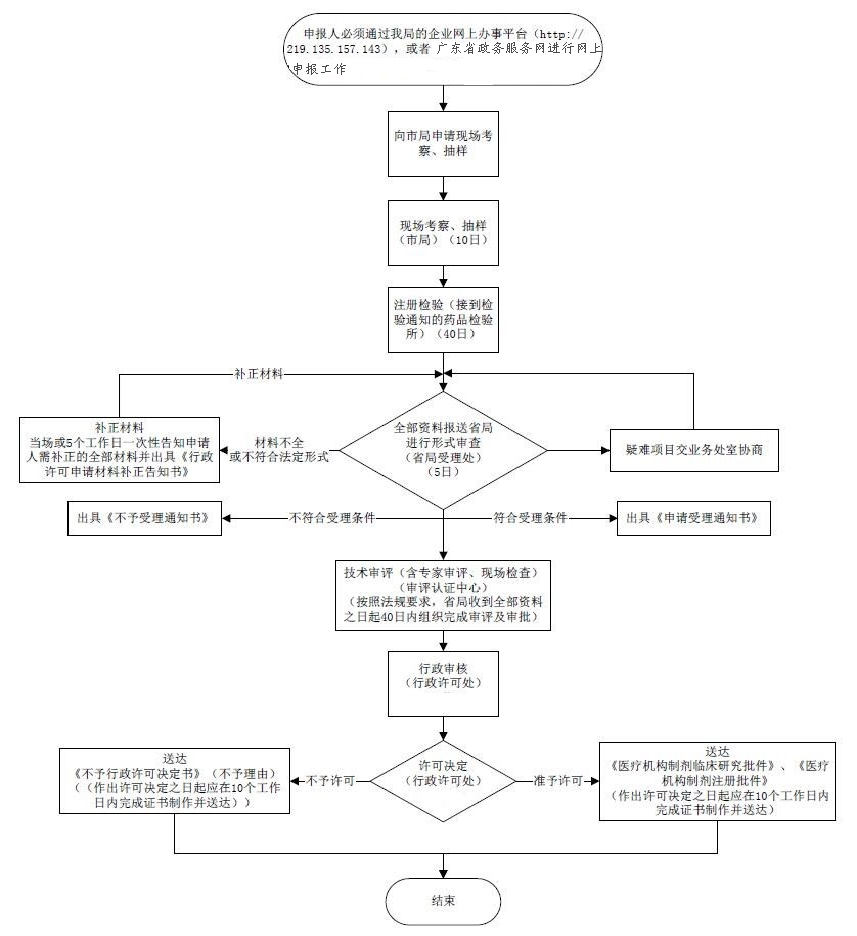
办理流程
流程文字说明
法定办理时限:20个工作日;承诺办理时限:10个工作日
1. 受理(时限:5个工作日)
办理结果:1.能当场受理或通过当场补正达到受理条件的,直接进入受理步骤,当场出具受理通知书;2.根据一次性告知通知书内容进行补正后达到受理条件的,出具决定受理通知书;3.收件之日起5个工作日内未收到一次性告知通知书的,从收件之日起即为受理。
2. 审查(时限:5个工作日)
办理结果:提出初步意见,转入决定步骤。
3. 决定(时限:5个工作日)
办理结果:1.申请符合规定的,准予行政许可。 2.申请不符合规定的,不准予行政许可。
4. 制证(时限:10个工作日)
办理结果:准予行政许可决定书 不准予行政许可决定书。
申请材料
1.医疗机构制剂注册申请表;>>医疗机构制剂注册申请表
2.制剂名称及命名依据;
3.立题目的以及该品种的市场供应情况;
4.证明性文件;
5.标签及说明书设计样稿;
6.处方组成、来源、理论依据以及使用背景情况;
7.配制工艺的研究资料及文献资料;
8.质量研究的试验资料及文献资料;
9.制剂的质量标准草案及起草说明;
10.样品的自检报告书;
11.制剂的稳定性试验资料;
12.辅料的来源及质量标准;
13.直接接触制剂的包装材料和容器的选择依据及质量标准;
14.主要药效学试验资料及文献资料;
15.急性毒性试验资料及文献资料;
16.长期毒性试验资料及文献资料;
17.临床研究方案。
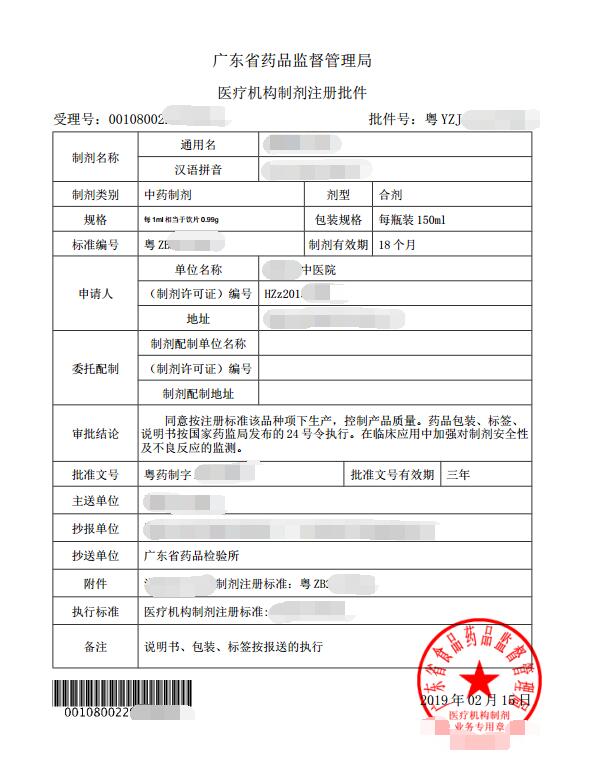
结果样本
常见问题
问题1:医疗机构制剂注册事项的相关问题
答:咨询人可到省局公众网站公众参与网上咨询平台查阅常见问题。
问题2:我们想要申请一个新的医疗机构制剂,我们能否委托企业帮我们进行研究呢?
答:详见《广东省食品药品监督管理局医疗机构制剂注册管理办法(试行)实施细则》第五条。申请人可以委托符合要求的机构进行制剂的研究或者进行单项试验、样品的试剂、配制等。委托方应当与被委托方签订委托研究合同。
问题3:请问我们在哪里可以申请到《医疗机构制剂临床研究批件》?
答:您可根据以下办事指南进行申请。http://www.gdzwfw.gov.cn/portal/guide/11440000MB2D034421244017200500101
问题4:我们已经完成了医疗机构制剂的临床研究,请问我们是向省药监局还是市药监局提出新制剂的申请呢?
答:答:根据《医疗机构制剂注册管理办法(试行》和《关于对医疗机构应用传统工艺配制中药制剂实施备案管理的公告》(2019年第19号),您所提到的问题是向广东省药品监督管理局提出申请,请在详细了解上述的办法及公告后,根据办事指南http://www.gdzwfw.gov.cn/portal/guide/11440000MB2D034421244017200500102进行申请。
问题5:我们家有一些祖传秘方,想申请院内中药制剂,这个具体需要提交什么材料和走什么流程?
答:医疗机构中药制剂的申请材料及申请流程,请参考如下办事指南:http://www.gdzwfw.gov.cn/portal/guide/11440000MB2D034421244017200500101。
问题6:医疗机构制剂(已有国家标准或省标准的)注册是否需要收费?收费/不收费的政策依据有哪些?
答:不收费。根据《行政许可法》第五十八条行政机关实施行政许可和对行政许可事项进行监督检查,不得收取任何费用。但是,法律、行政法规另有规定的,依照其规定。行政机关提供行政许可申请书格式文本,不得收费。行政机关实施行政许可所需经费应当列入本行政机关的预算,由本级财政予以保障,按照批准的预算予以核拨。
问题7:医疗机构没有医疗机构制剂许可证,能否进行医疗机构制剂的申请呢?
答:根据《医疗机构制剂注册管理办法(试行》和《关于对医疗机构应用传统工艺配制中药制剂实施备案管理的公告》(2019年第19号),医疗机构未取得《医疗机构制剂许可证》或无对应配制范围的医院可以申请中药制剂注册,在申请配制时同时提出委托配制的申请。
问题8:医疗机构制剂的申请需要多长时间呢?
答:《医疗机构制剂注册管理办法(试行》、《关于对医疗机构应用传统工艺配制中药制剂实施备案管理的公告》(2019年第19号),请在详细了解上述的办法及公告后,根据您申请的实际情况选择以下不同的办事指南进行了解: 1)注册 (http://www.gdzwfw.gov.cn/portal/guide/11440000MB2D034421244017200500102) 2)备案 (http://www.gdzwfw.gov.cn/portal/guide/11440000MB2D0344212442072091001)。
问题9:如何界定医疗机构制剂是属于注册品种还是备案品种?
答:您可详细了解以下办法及公告《医疗机构制剂注册管理办法(试行》、《关于对医疗机构应用传统工艺配制中药制剂实施备案管理的公告》(2019年第19号),《关于对医疗机构应用传统工艺配制中药制剂实施备案管理的公告》(2019年第19号)规定,备案的适用范围为(1)由中药饮片经粉碎或仅经水或油提取制成的固体(丸剂、散剂、丹剂、锭剂等)、半固体(膏滋、膏药等)和液体(汤剂等)传统剂型;(2)由中药饮片经水提取制成的颗粒剂以及由中药饮片经粉碎后制成的胶囊剂;(3)由中药饮片用传统方法提取制成的酒剂、酊剂。以上情型除外的均为注册品种。
本办事指南摘自药监局官网,如有变动,以官方发布为准。