基本信息
1、办理部门:江苏省药品监督管理局
2、办理方式:网上办理
3、办理地点:南京市建邺区汉中门大街145号江苏省政务服务中心省药监局窗口
4、咨询电话: 12315 CIO咨询:400-003-0818
受理条件
材料齐全,符合法定形式。
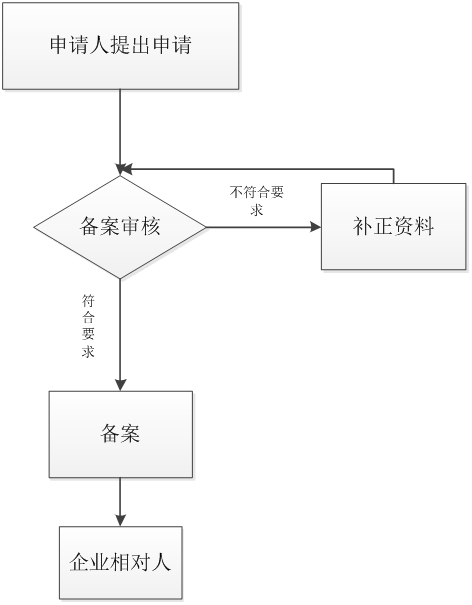
办理流程
流程文字说明
1、受理(时限:5个工作日)
办理结果:在5个工作日内,对不属于许可范畴或不属于本机关职权范围的,不予受理,并出具《不予受理通知书》;对申请资料不齐全或不符合法定形式的,出具《补正通知书》,一次性告知申请人需要补正的全部内容;对申报资料齐全或已经按照要求提交全部补正申请资料的申请作出受理决定,出具《受理通知书》。
2、审查、决定(时限:10个工作日)
办理结果:变更文件。
申请材料
结果样本
无。
常见问题
问题1:医疗器械产品上的说明书和标签不能出现哪些内容?
答:依据《医疗器械说明书和标签管理规定》(食品药品监督管理总局令第6号)第十四条,医疗器械说明书和标签不得有下列内容:
(1)含有“疗效最佳”、“保证治愈”、“包治”、“根治”、“即刻见效”、“完全无毒副作用”等表示功效的断言或者保证的;
(2)含有“最高技术”、“最科学”、“最先进”、“最佳”等绝对化语言和表示的;
(3)说明治愈率或者有效率的;
(4)与其他企业产品的功效和安全性相比较的;
(5)含有“保险公司保险”、“无效退款”等承诺性语言的;
(6)利用任何单位或者个人的名义、形象作证明或者推荐的;
(7)含有误导性说明,使人感到已经患某种疾病,或者使人误解不使用该医疗器械会患某种疾病或者加重病情的表述,以及其他虚假、夸大、误导性的内容;
(8)法律、法规规定禁止的其他内容。
本办事指南摘自药监局官网,如有变动,以官方发布为准。