基本信息
1、办理部门:江苏省药品监督管理局
2、办理方式:网上办理
3、办理地点:南京市建邺区汉中门大街145号江苏省政务服务中心省药监局窗口
4、咨询电话: 12315 CIO咨询:400-003-0818
受理条件
《中华人民共和国行政许可法》第三十二条第五项: 申请事项属于本行政机关职权范围,申请材料齐全、符合法定形式,或者申请人按照本行政机关的要求提交全部补正申请材料的,应当受理行政许可申请。
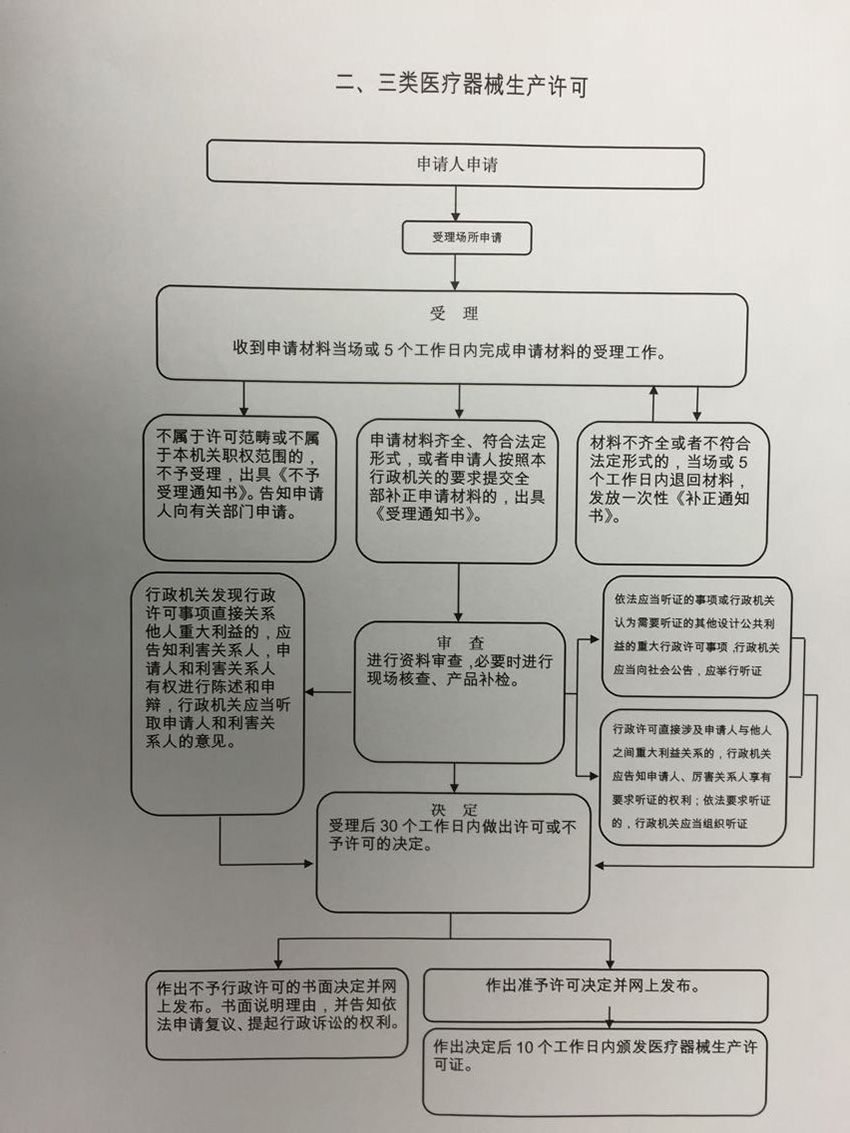
办理流程
流程文字说明
1、审查、决定(时限:20个工作日)
办理结果:根据《医疗器械生产监督管理办法》,对申请材料进行实质内容审查,并做出决定。
申请材料
1、1.医疗器械生产许可申请表;>>申请表
2、2.所生产的医疗器械注册证以及产品技术要求;
3、3.法定代表人、企业负责人身份证明复印件;>>企业提供申报资料说明
4、4.生产、质量和技术负责人的身份、学历、职称相关材料;
5、5.生产管理、质量检验岗位从业人员学历、职称一览表;
6、6.生产场地的相关文件;>>生产管理、质量检验岗位人员一览表
7、6.1产权证明、租赁合同复印件;
8、6.2生产地址地理位置图;
9、6.3厂区平面布局;
10、6.4有特殊生产环境要求的,还应当提交设施、环境的相 关文件(如洁净车间平面布局图、新洁净区有资质机构出具的洁净车间环境检验合格报告、辐射防护证明文件);
11、7.主要生产设备和检验设备目录;
12、7.1主要生产设备器具目录;
13、7.2进货、过程、成品检验设备目录;
14、7.3进货、过程、成品检验规程;
15、8.质量手册和程序文件目录;
16、8.1质量手册和程序文件目录;
17、8.2医疗器械质量管理规范等现场检查申请表;>>核查申请表
18、8.3现场检查的特别说明(如申请部分产品现场考核、书面审核或免于现场考核情形的理由及证明资料,如适用);
19、8.4现场考核后提交现场检查记录表含情况说明(如适用);
20、8.5企业整改报告(如适用);
21、8.6复查申请和/或复查报告(如适用);
22、9.详细工艺流程图(需注明主要生产方式、外购外协件、关键工序和特殊过程及各工序的生产环境要求);
23、10.证明售后服务能力的相关材料;
24、10.1关于售后服务能力和责任的自我保证声明;
25、10.2售后服务制度文件,如产品安装、维修保养、质量跟踪、用户反馈和质量事故报告;
26、10.3证明售后服务能力其 他资料(如有);
27、11.经办人的授权文件;>>授权委托书
28、12.生产许可证注销文件(企业未在规定期限内申请许可证延续的需提供);
29、13.其他证明资料(如门牌变动证明、优先或创新产品证明);
30、14.主文档授权信(如适用);
31、15.资料真实性保证声明(含申请企业承诺);>>承诺书
32、16.拟生产的产品说明书和标签样稿(受托生产适用);
33、17.委托生产合同(受托生产适用);
34、18.委托生产质量协议(受托生产适用);
35、19.知识产权保护协议(如适用)(受托生产适用);
36、20. 对受托企业考核评估报告(受托生产适用);
37、21.注册人证明售后服务能力的相关材料(受托生产适用);
38、21.1关于售后服务能力和责任的保证声明;
39、21.2售后服务制度文件,如产品安装、维修保养、质量跟踪、用户反馈和质量事故报告(如有);
40、21.3证明售后服务能力其 他资料(如有)。
结果样本

常见问题
问题1:《医疗器械生产许可证》有效期是多长?
答:有效期为5年。
本办事指南摘自药监局官网,如有变动,以官方发布为准。