 E邀专家
E邀专家
MAH变更细节确定!涉及生物制品
CIO专家-燕窝
为配合药品注册管理办法实施,刚刚,国家药监局发布了《已上市生物制品变更事项及申报资料要求》的通告(2021年第40号),自发布之日起实施。
本文小编将结合国家药监局2021年1月13日发布的《药品上市后变更管理办法(试行)》,给大家梳理与生物制品有关的MAH变更事项申请,为药品注册申报人员提供参考。
一、生物制品变更事项分类
已上市生物制品变更事项分为三类:国家药品监管部门审批的补充申请事项;国家或省级药品监管部门备案事项;年报事项。补充申请事项包括药学、临床变更相关技术指导原则中属于重大变更的事项,药品上市许可持有人主体变更,使用药品商品名等。备案事项包括药学、临床变更相关技术指导原则中属于中等变更的事项,改变不涉及技术审评的药品注册证书载明事项,境外生产药品分包装及其变更等。年报事项包括药学、临床变更相关技术指导原则中属于微小变更的事项等。
二、生物制品变更审批流程
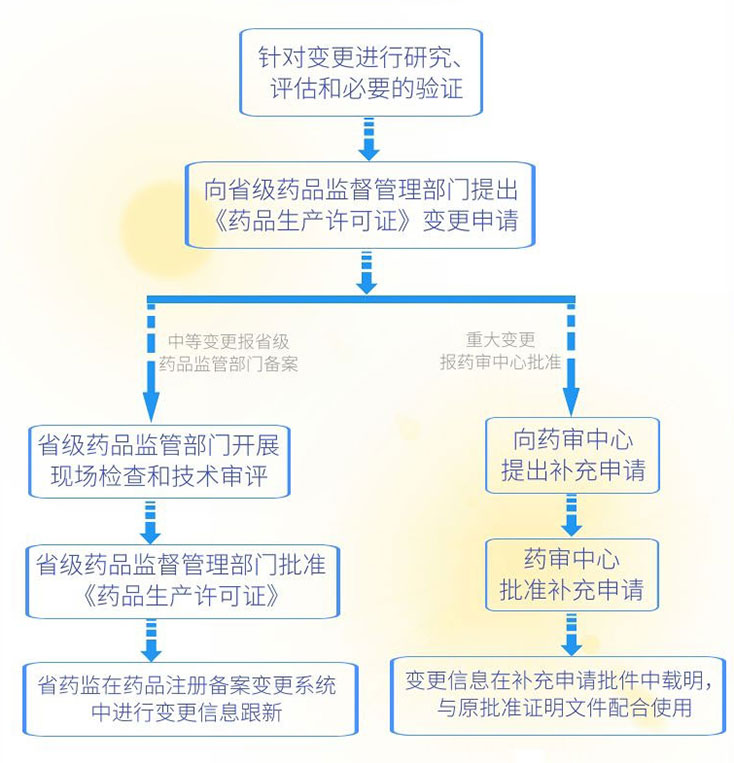
三、申报资料要求
根据所申请事项,按以下编号及顺序提交申报资料:
1.药品批准证明文件及其附件的复印件。
2.证明性文件。
3.检查检验相关信息。包括药品研制情况信息表、药品生产情况信息表、现场主文件清单、药品注册临床试验研究信息表、临床试验信息表以及检验报告。
4.修订的药品质量标准、生产工艺、说明书、标签样稿,并附详细修订说明。
5.药学研究资料。
6.药理毒理研究资料。
7.临床研究资料。
8.国家药品监管部门规定的其他资料。
如今关于药品上市许可持有人变更的办事流程越来越明确了,也给药品研发注册管理人员指明了工作方向,CIO合规保证组织从2018年药品上市许可持有人制度试点开始,一直参与深度研究,并参与了广东省药品监督管理局研究课题。目前,已经指导多家研究机构成功申请成为MAH,CIO合规保证组织专家们很乐于与行业人士分享经验,提供相关法律法规咨询服务,指导建立变更后质量管理体系,欢迎业内人士多多交流。
CIO合规保证组织,专注研究医药监管科学,促进医药产业合规、快速发展,努力为中国医药转型升级服务,成为最专业的第三方服务机构。
更多合规服务,详看以下链接:
合规文库:已上市生物制品变更事项及申报资料要求
合规培训:《药品上市后变更分类及流程》解读
合规服务:生产场地变更(生物制品)
远程服务:
 E邀专家
E邀专家























