 E邀专家
E邀专家
CDE五连发!仿制药上市新规、新版GCP将于2026年3月施行!
CIO专家-山丹
1、《化学药品仿制药上市许可申请模块二药学资料撰写要求(试行)》
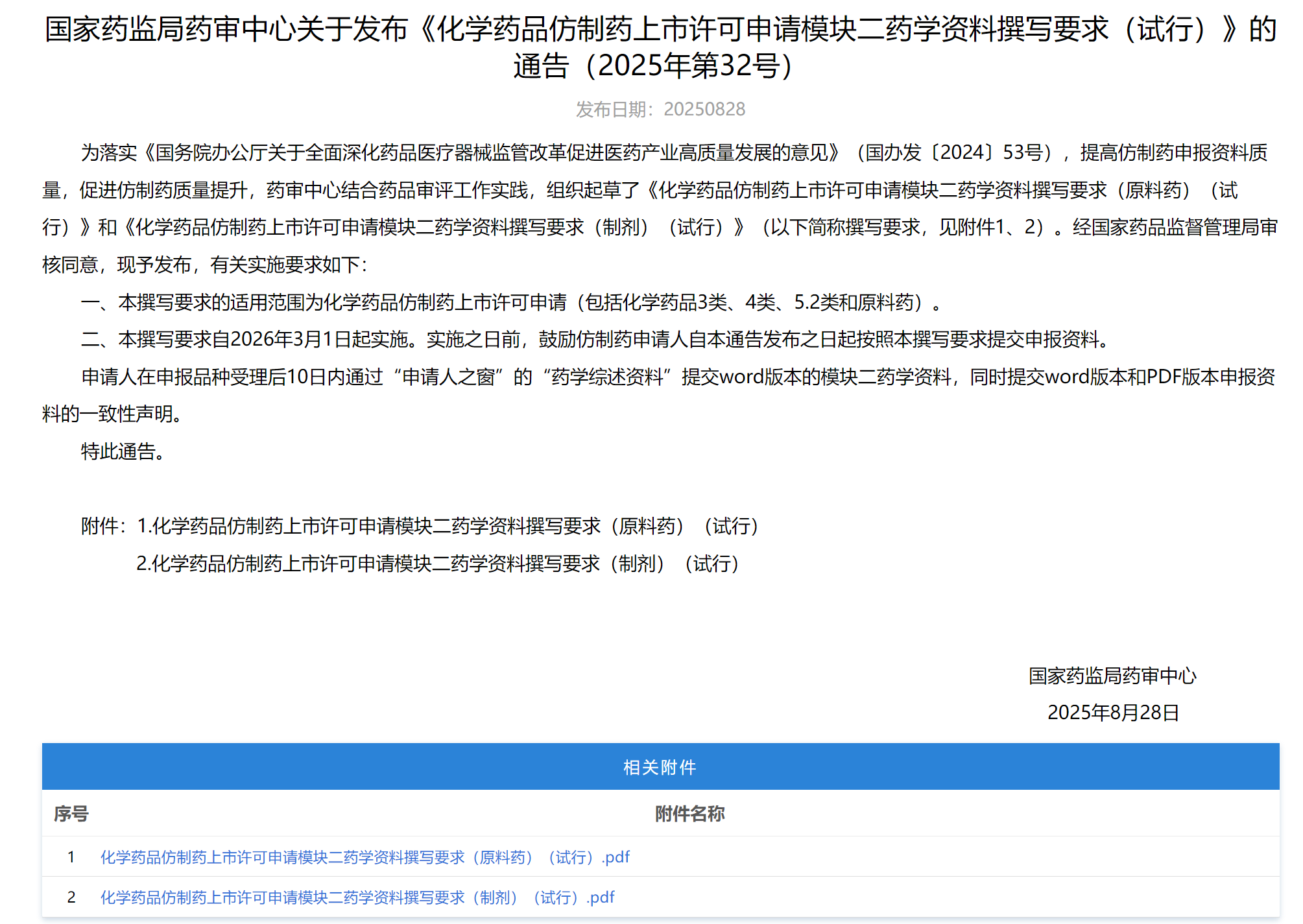
适用于化学药品仿制药上市许可申请,自2026年3月1日起实施,实施之日前,鼓励仿制药申请人自本通告发布之日起按照本撰写要求提交申报资料。
2、《疫苗佐剂非临床研究技术指导原则》
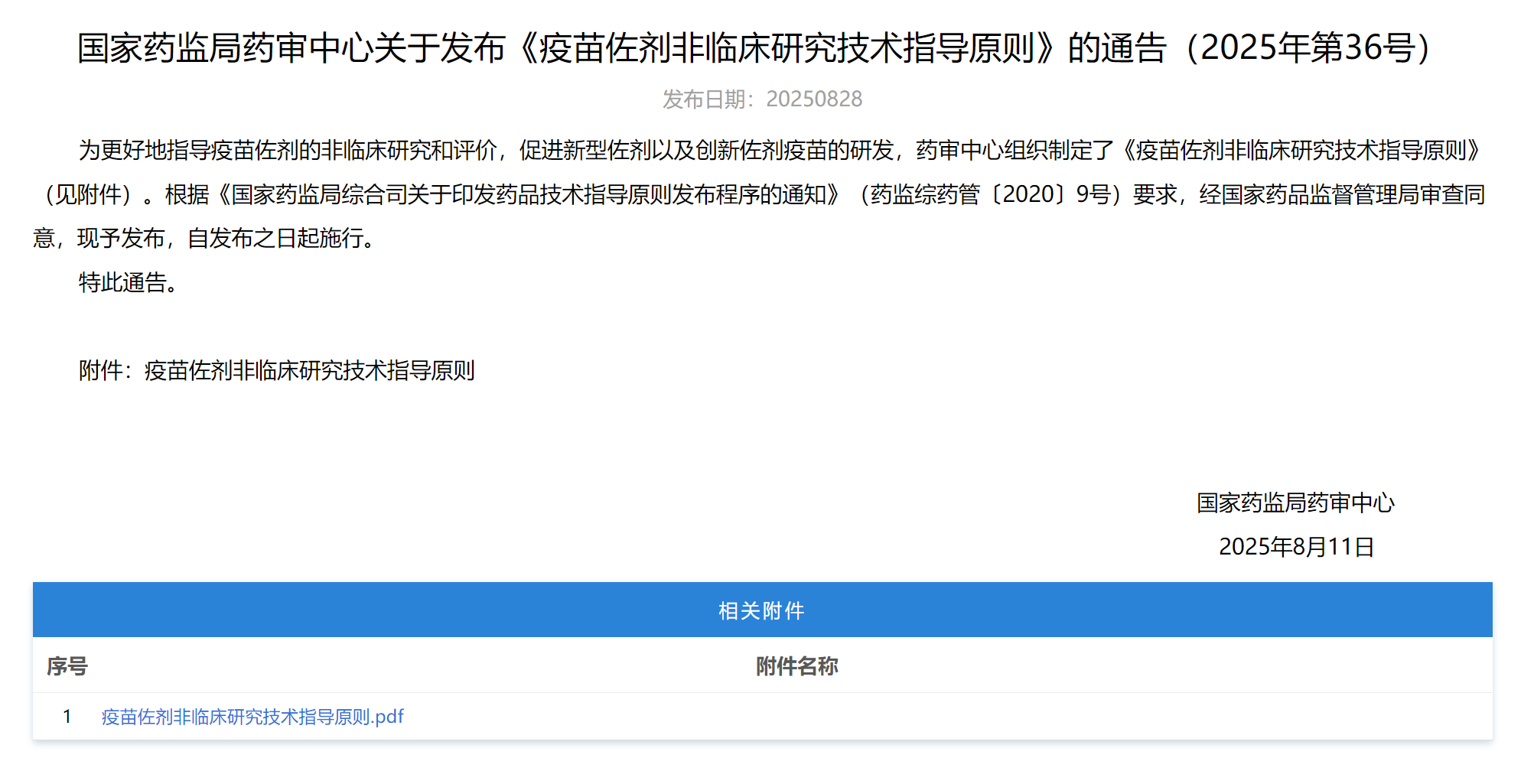
适用于感染性疾病的疫苗佐剂,旨在为其 非临床研究的设计和开展提供一般性技术建议,以促进新 型佐剂以及创新佐剂疫苗的研发。该指导原则自发布之日起施行。
3、《化学仿制药参比制剂目录(第九十七批)》(征求意见稿)
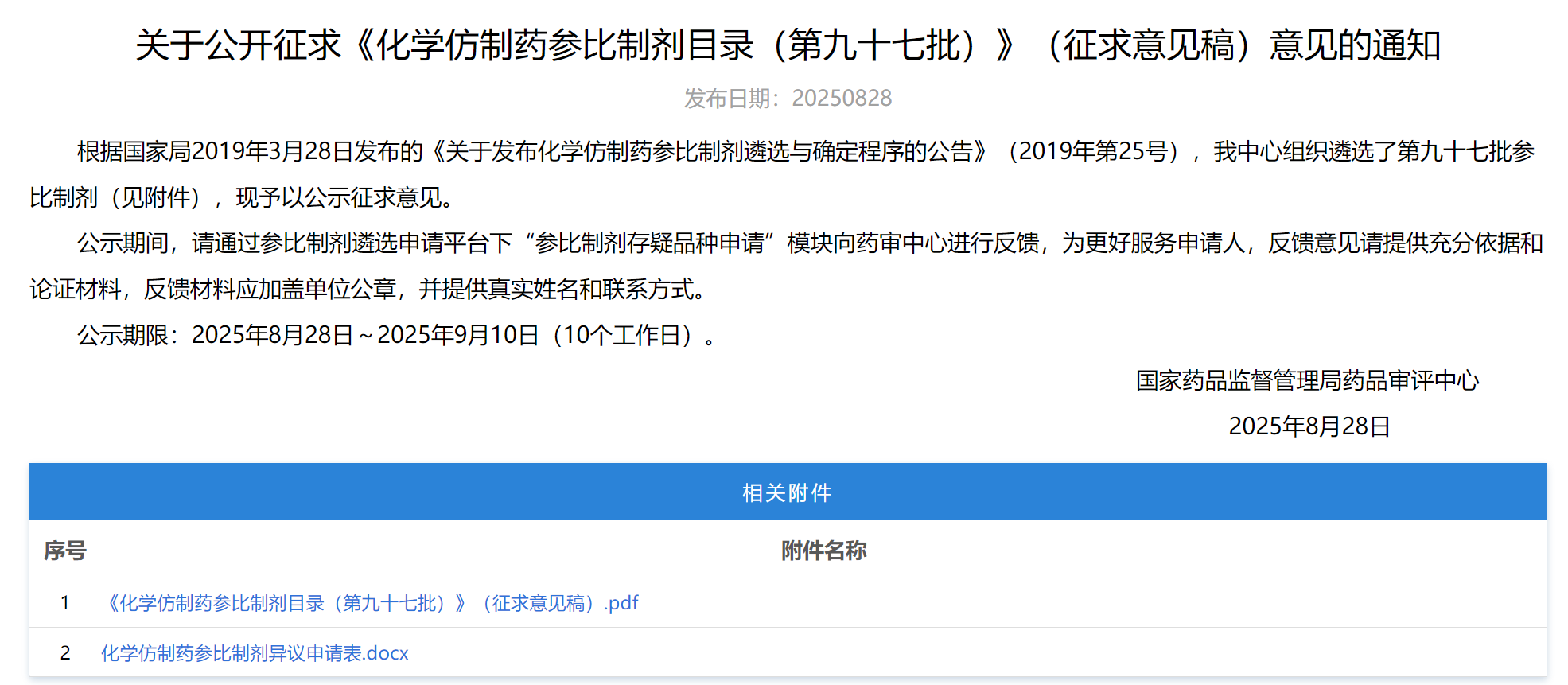
化学仿制药参比制剂遴选,第九十七批,公示征求意见,截止于2025年9月10日。
4、《预防用生物制品批准后药学变更管理方案技术指导原则(征求意见稿)》
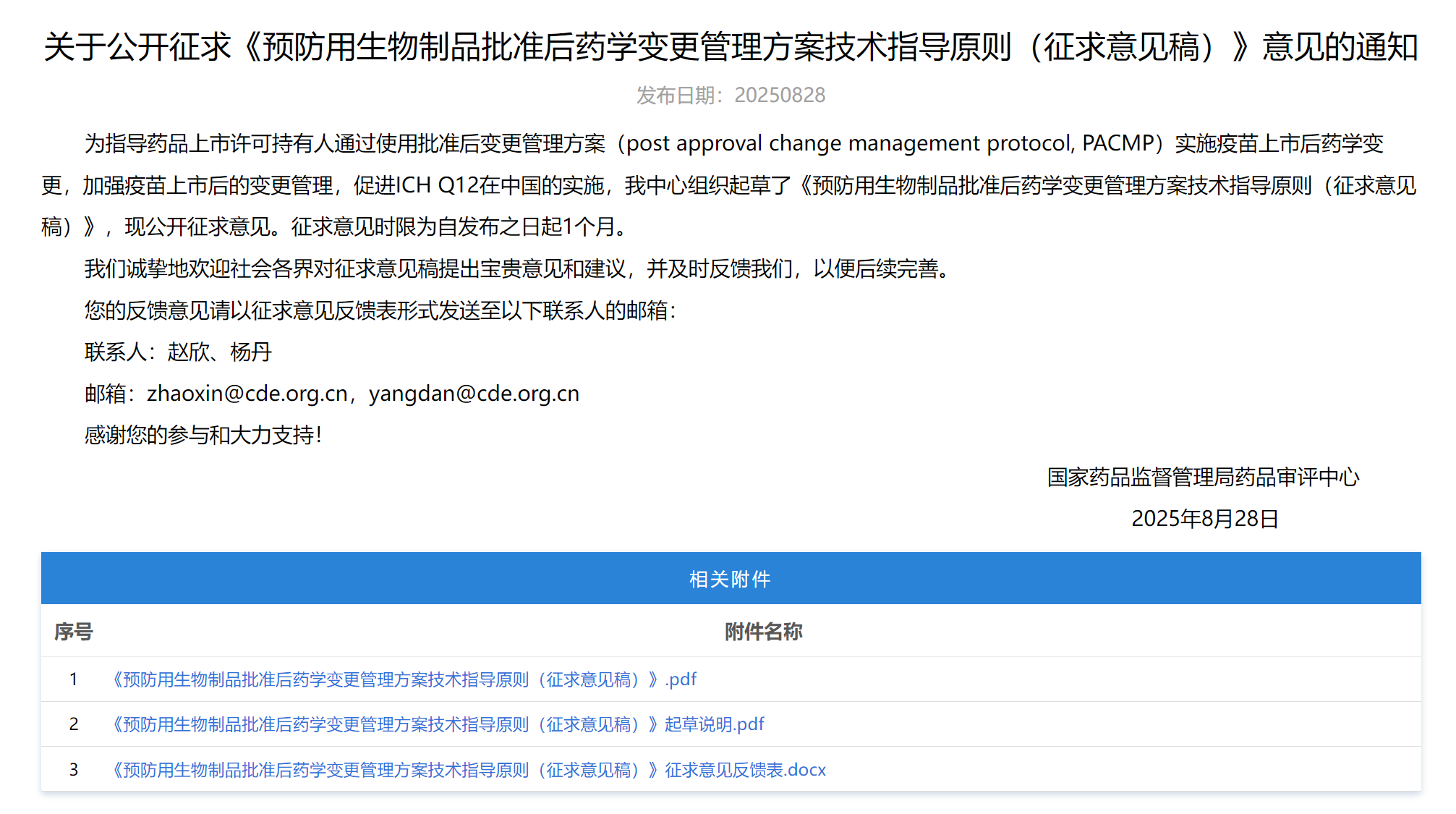
用以支持预防用生物制品产业发展和结构优化,提升生产工艺和质量水平,加强上市后的变更管理,促进 ICH Q12《药品生命周期管理的技术和监管考虑》在中国的实施。
5、ICH《E6(R3):药物临床试验质量管理规范技术指导原则(GCP)》原则及附件1实施建议
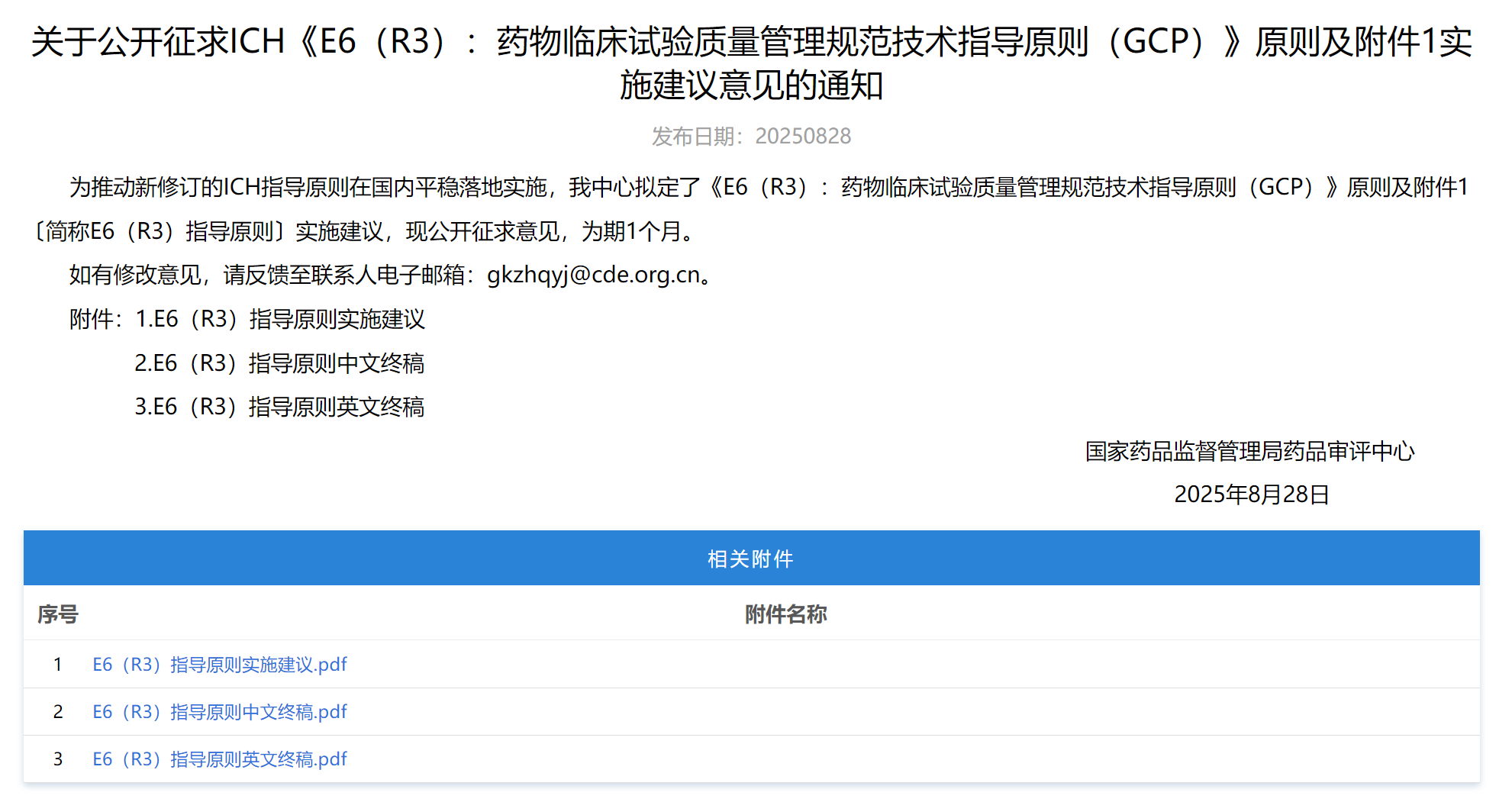
为新版ICH 临床试验质量管理规范(GCP),CDE拟自2026年3月31日起开始的临床试验,均适用ICH E6(R3)指导原则。
有疑问、问专家
提问
 E邀专家
E邀专家
最新推荐
热门观点
分享






















