基本信息
1. 办理部门:广东省药品监督管理局
2. 办理方式:网上办理
3. 办理地点:广州市黄花岗街道东风东路753号之二一楼受理大厅
4. 药监咨询:020-37886014 CIO咨询:400-003-0818
受理条件
申请再注册的药品批准文号在有效期内,并应在有效期届满前6个月提出。
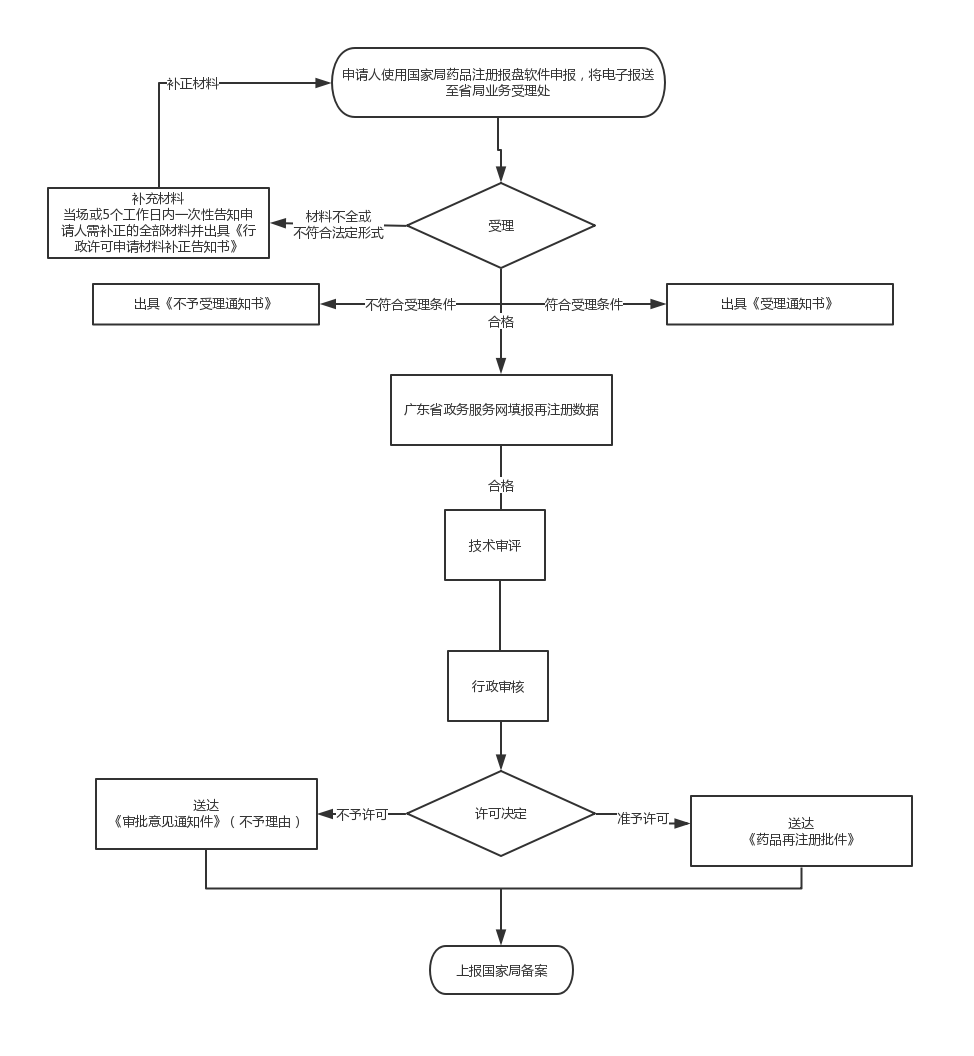
办理流程
流程文字说明
法定办结时限:30个工作日;承诺办结时限:9个工作日。
1.受理(时限:4个工作日)
办理结果:1.能当场受理或通过当场补正达到受理条件的,直接进入受理步骤,当场出具受理通知书;2.根据一次性告知通知书内容进行补正后达到受理条件的,出具决定受理通知书;3.收件之日起4个工作日内未收到一次性告知通知书的,从收件之日起即为受理。
2.审查(时限:3个工作日)
办理结果:提出初步意见,转入决定步骤。
3.决定(时限:2个工作日)
办理结果:1.申请符合国家未开放档案利用规定的,准予行政许可。 2.申请不符合国家未开放档案利用规定的,不准予行政许可。
4.制证(时限:7个工作日)
办理结果:准予行政许可决定书 不准予行政许可决定书
5.送达(时限:3个工作日)
办理结果:1.准予行政许可的颁发《准予行政许可决定书》 2.不予行政许可的颁发《不予行政许可决定书》
>>委托办理咨询药品再注册申请
网上办理流程
申请材料
1.药品处方、生产工艺、药品标准;
2.药品批准证明文件及其附件的复印件;
3.五年内生产、销售、抽验情况总结;
4.五年内药品临床使用情况及不良反应情况总结。
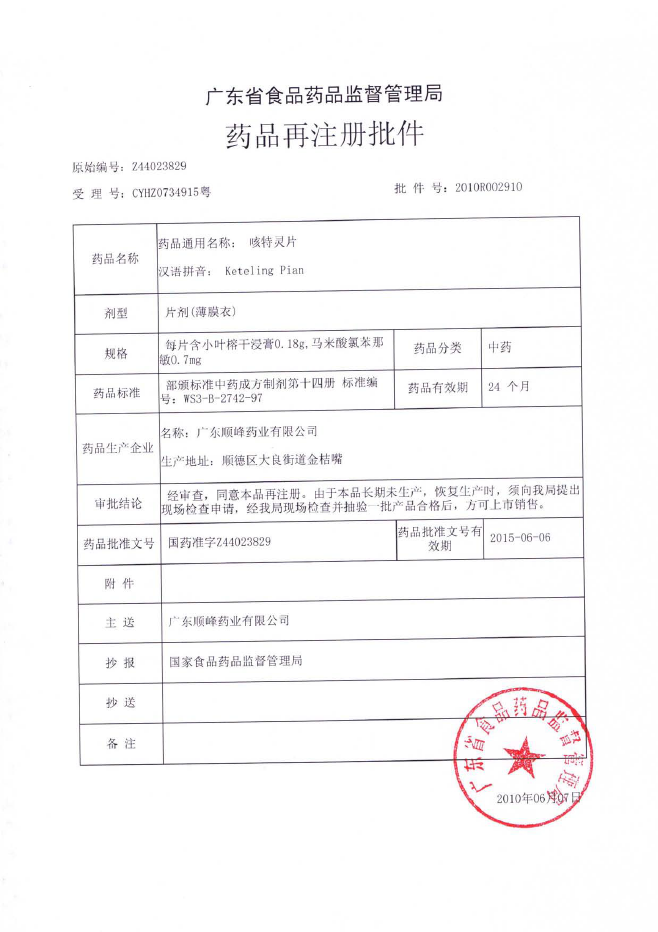
结果样本
常见问题
问题1:药品再注册事项的相关问题
答:咨询人可到省局公众网站公众参与网上咨询平台查阅常见问题。
问题2:可以提前多久申请药品再注册?
答:申请人应当在有效期届满前1年申请再注册。
问题3:药品再注册可以同一个品种一起申报吗?
答:按批准文号逐一申报。对于同品种不同规格的,建议同期一起提出申请。
问题4:申请表中的执行标准是填写上次再注册批件中的执行标准吗?
答:申请表中的执行标准填写现行执行标准,同时在技术审评的资料中填写变更历史信息。
问题5:药品再注册申报时如何获取定期安全更新报告?
答:先向省局不良反应中心申报,直接在省局系统对应批准文号获取对应报告编码。
问题6:药品再注册缴费单如何获取?
答:省局受理后会将受理单及缴费单寄往申请人预留的地址。
问题7:药品再注册需要提交纸质申请表吗?
答:不需要,将申请表盖章后扫描上传至附件即可。
问题8:药品再注册批件需要来现场领取吗?
答:不需要。我局制证后会将批件寄往申请人预留的地址。
问题9:药品再注册5年生产销售数据从什么时间算起?
答:以上次批准再注册批件起五年内。
本办事指南摘自药监局官网,如有变动,以官方发布为准。

























