基本信息
1、办理部门:河南省药品监督管理局
2、办理方式:窗口办理、网上办理、快递申请
3、办理地点:河南省郑州市郑东新区农业南路与祥盛街交叉口向东100米路南,中原出版产业园南区D座一楼河南省政务服务中心
4、咨询电话:0371-65569709 CIO咨询:400-003-0818
受理条件
1.申报产品已确定为第二类体外诊断试剂,注册申请人为河南省省内企业;
2.按照有关规定取得企业营业执照或事业单位法人证书;
3.已具备拟注册产品的生产能力,并按照要求建立医疗器械注册质量管理体系;
4.已参照执行国家药品监督管理局已发布的相应技术指导原则;
5.已编制拟申请产品技术要求,完成注册检测;
6.已完成临床评价;
7.办理体外诊断试剂注册申请的人员具有相应的专业知识,熟悉医疗器械注册管理的法规、规章和有关的技术要求。
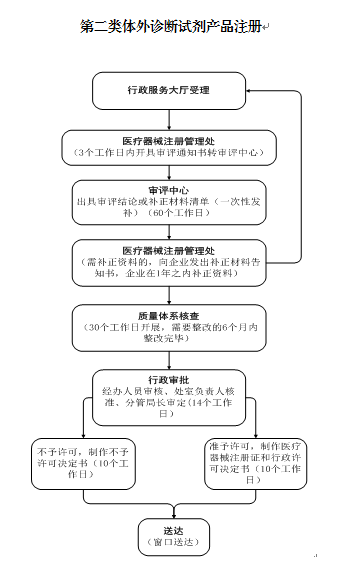
办理流程
流程文字说明
法定办理时限:20个工作日;承诺办理时限:10个工作日
1、受理(时限:5个工作日)
办理结果:受理通知书/不予受理通知书/一次性告知通知书。
2、审核(时限:6个工作日)
办理结果:审查意见。
3、决定(时限:4个工作日)
办理结果:中华人民共和国医疗器械注册变更文件(体外诊断试剂)。
4、送达(时限:10个工作日)
办理结果:送达回执。
申请材料
1、监管信息(第二类体外诊断试剂产品注册);
2、综述资料((第二类体外诊断试剂产品注册);
3、非临床资料(第二类体外诊断试剂产品注册);
4、临床评价资料(第二类体外诊断试剂产品注册);
5、产品说明书和标签样稿(第二类体外诊断试剂产品注册);
6、质量管理体系文件(第二类体外诊断试剂产品注册)。
结果样本

常见问题
问题1:体外诊断试剂产品发生变化的需要进行注册变更申请吗?
答:《体外诊断试剂注册与备案管理办法》(国家市场监督管理总局令第48号)第九条:“……第二类、第三类医疗器械实行注册管理。……境内第二类医疗器械由省、自治区、直辖市药品监督管理部门审查,批准后发给医疗器械注册证。……”
第七十八条:“已注册的第二类、第三类体外诊断试剂产品,其设计、原材料、生产工艺、适用范围、使用方法等发生实质性变化,有可能影响体外诊断试剂安全、有效的,注册人应当向原注册部门申请办理变更注册手续;...... 注册证载明的产品名称、包装规格、主要组成成分、预期用途、产品技术要求、产品说明书、进口体外诊断试剂的生产地址等,属于欠款规定的需要办理变更注册的事项。……
本办事指南摘自药监局官网,如有变动,以官方发布为准。

























