 E邀专家
E邀专家
一、不符合项分布情况
从规范独立软件附录各章节不符合项分布情况(见图一)来看,设计开发占比最多,不合格品控制无不合格项。占前五位的分别为设计开发(59%)、生产管理(8%)、机构与人员(8%)、质量管理(6%)和文件与记录(5%)。
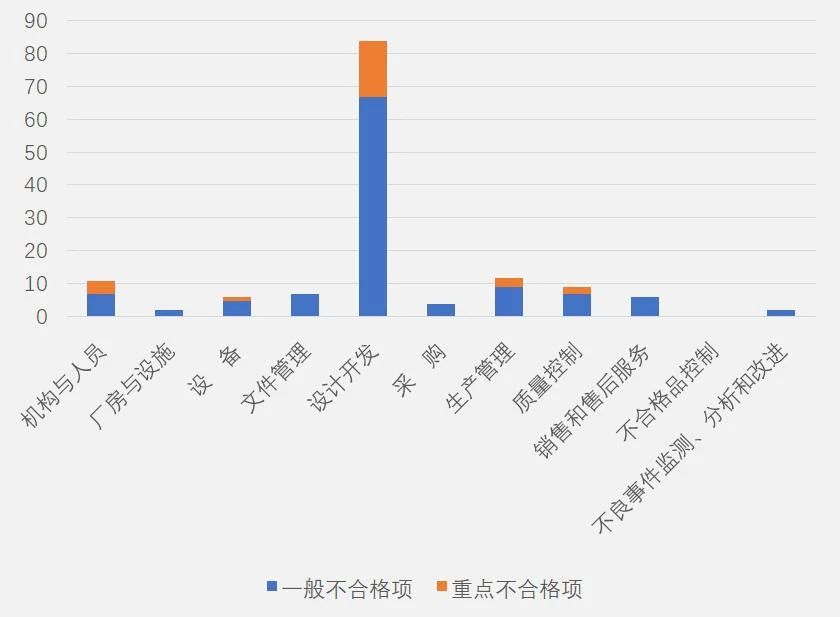
▵ 图一:规范独立软件附录各章节不符合项分布
进一步分析设计开发部分,主要不合格项集中在“软件测试、设计、现成软件使用、验证和缺陷管理”等五个方面(见图二)。
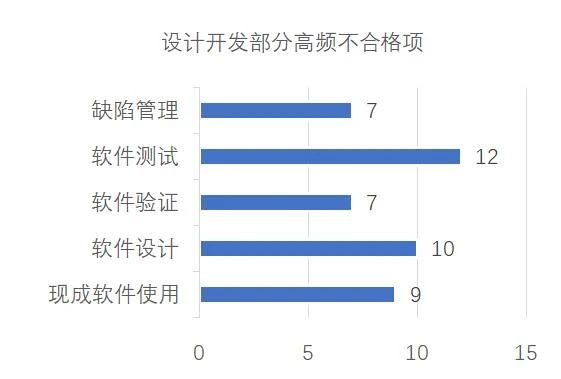
▵ 图二:设计开发不合格项分布
二、现场核查常见问题
通过分析上述不合格项的数据,主要存在以下方面问题:
(1)软件需求内容较为简单,未覆盖独立软件产品部分已实现功能,需求规格书中缺乏对交互界面、性能、风险分析以及标准要求等相关内容描述。软件设计未根据软件需求实施系统设计,设计要求不明确或有遗漏,详细设计不充分。部分企业对于软件可追溯性分析要求认识不充分,未有效实施贯穿软件需求、软件设计、软件测试、软件风险等相关的软件可追溯性分析。
(2)软件测试用例过于简单,未覆盖风险项,可操作性差,测试数据不明确或使用不规范,导致软件验证不充分。软件测试(含单元、集成以及系统测试)未依据相应测试计划实施,未形成相应软件测试报告以及评审记录,并未适时更新。
(3)软件缺陷管理缺乏缺陷分析评估、软件缺陷修复、回归测试、风险管理、配置管理、评审等活动的相关要求及记录。
(4)未充分识别现成软件,现成软件使用也未按要求形成文件和记录。软件配置管理要求不明确,配置管理记录缺失或不完整。软件版本变更未按软件版本命名规则进行管理变更。
(5)部分企业仍存在测试人员与开发人员职责不清、同一项目开发人员既编码又承担黑盒测试的情况。
(6)独立软件交付物的生产及检验要求不明确,相关记录缺失或不完整。
三、对软件生产企业的建议
独立软件具有特殊性,由于需求不明确,风险分析不充分,测试不充分,会引发软件频繁变更,可能导致在产品上市后引起严重后果。通过对2022年现场检查不合格项分析,对于机构与人员、设计开发、生产管理和质量控制等主要环节,提出以下建议:
(1)软件开发过程中须明确规定软件开发人员与测试人员的职责,避免同一软件项开发与黑盒测试由一人实施的情况。
(2)应当基于软件生存周期过程控制要求严格实施软件需求分析、设计、验证及确认等主要软件开发活动,加强软件质量意识,提高软件测试用例质量和测试能力。同时,加强对软件配置管理、现成软件使用、缺陷管理和软件版本管理等活动的控制。
(3)在生产管理方面,应当确保软件发布的一致性、可重复性;不同交付方式(物理交付、软件交付)应当明确相应的要求等。
(4)在质量控制方面,软件的放行程序应当明确软件版本、完整性检查等要求和记录。
*本文来源 - - 器械早班车微信公众号
相关文件下载、服务及学习课程:
合规培训:独立软件器械注册要点
委托定制:医疗器械生产企业GMP合规审计
联系专家,获取专家指导意见:e邀专家
*以上文章仅代表作者个人观点。本文为转载文章,版权归原作者所有,如涉侵权,请联系我们删除。
 E邀专家
E邀专家























