 E邀专家
E邀专家
创新药企心血管代谢产品线布局探索
CIO专家-山丹
这是本人在2023年长城心血管会议上的分享。主要内容包括:1)我国创新药企机遇和挑战;2)创新药企心血管产品线布局及信达生物的案例。小插曲,这次分享很巧被安排在王亚宁博士旁边,有幸跟网红科学家同台演出。
一、创新药企机遇和挑战
机遇:我国创新药企近年来取得了显著的发展,这要归功于多个推动因素。1)首先,政策支持发挥了关键作用。国家出台了一系列支持创新药研发和上市的政策,如健康中国2030规划、新版药品管理法和药品上市许可持有人制度等。这些政策为创新药企提供了更好的发展环境和机会。2)其次,市场需求的增加也是推动创新药企发展的重要因素。随着患者人群的增加、老龄化趋势、消费升级以及国际市场的开放,这为企业提供了更多的商机和发展空间。3)此外,资本助力也为创新药企的发展提供了重要支持。国内外资金的涌入以及一级和二级市场对创新药企的关注度提升,为企业提供了更多的融资渠道和资金支持。4)最后,研发实力的提升也是我国创新药企发展的重要推动力。科学和技术水平的提升、国内企业创新能力的增强以及优秀人才的涌现,为企业的创新药研发奠定了坚实的基础。这些因素的共同推动下,我国创新药企得到了快速发展。

根据世界卫生组织2019年的数据,中国已经成为全球第二大医药市场,仅次于美国,超过了日本、德国、法国和英国。这一数据反映了中国在医药领域的快速发展和巨大潜力。另外,在新分子实体的研发方面,根据医药魔方今年8月份的数据,中国的新分子实体临床开放项目包括IND申请、I期、II期、III期临床和申请上市的项目约有4500项,而美国约有5000项,仅低10%,这使得中国在全球范围内排名第二,位居日本、德国、法国、英国之前,并且研发管线贡献率占全球的35%。这些数据表明,中国在医药领域的研发实力和创新能力得到了显著提升。
挑战:尽管我们取得了一些成绩,但仍然面临着不少困难。首先是研发方面的挑战。创新药物的研发周期长,成本不断上升,研发生态系统尚未完全成熟,而且研发靶点集中在一些热门领域。这些因素都增加了创新药物研发的难度。其次是商业化方面的挑战。创新药物在市场上的覆盖能力有限,新药市场准入困难,医保控费力度大,药品进入医院的难度也很大。此外,创新药物之间差异化不大,面临着同质化竞争的压力。最后是资金方面的挑战。当前资本市场经历了一段寒冬,投资者对风险的容忍度下降,这对企业的融资能力产生了影响。此外,资本市场的不稳定性也给企业带来了一定的不确定性。
产品线布局需注重资源的有效配置和价值的最大化。通过评估市场需求、技术优势、研发进展、资源配置等因素,选择最有价值的产品组合进行投资,实现企业的长期成功和可持续发展。
二、创新药企产品线布局的核心要素
创新药企产品线布局的核心要素包括战略规划、聚焦核心、投资回报肯定和风险管理。

1)首先,战略规划是创新药企产品线布局的基础。企业需要明确其长期目标和愿景,并制定相应的战略计划。这包括确定公司的核心竞争力和市场定位,以及确定产品线的发展方向和重点领域。战略规划需要综合考虑市场需求、技术能力、竞争态势等因素,确保产品线布局与企业战略的一致性。
2)其次,聚焦核心是确保创新药企产品线布局成功的关键。企业应该专注于自身的核心业务和核心技术领域,避免过度分散资源和精力。通过聚焦核心,企业可以更好地发挥自身优势,提高研发效率和产品质量。此外,聚焦核心还可以帮助企业建立品牌形象和市场认知,提升市场竞争力。
3)此外,投资回报是衡量创新药企产品线布局成功与否的重要指标。企业在产品线布局时需要综合考虑市场规模、竞争态势、技术难度等因素,合理评估投资回报的潜力。企业需要进行市场调研和风险评估,制定合理的投资计划和预期收益,并根据实际情况进行动态调整。投资回报肯定的评估可以帮助企业优化资源配置,提高投资效益。
4)最后,风险管理是创新药企产品线布局不可忽视的方面。创新药研发具有高风险性和不确定性,产品线布局涉及到市场风险、技术风险、法规风险等多方面的风险。企业需要建立完善的风险管理体系,包括风险识别、风险评估、风险控制和风险应对等环节。通过科学的风险管理,企业可以降低风险带来的损失,提高产品线布局的成功率。
综上所述,创新药企产品线布局的核心要素包括战略规划、聚焦核心、投资回报肯定和风险管理。企业需要在这些要素的指导下,制定科学合理的产品线布局策略,提高研发效率和市场竞争力,实现可持续发展。
三、案例分析-信达生物心血管代谢产品线布局及研发概况
信达心血管代谢产品线布局
信达生物是一家生物制药企业,成立于2011年,2023年8月24日迎来了12周年庆典。在过去十年中,信达从一家生物技术公司发展为具备研发、生产和商业化能力的制药企业。自去年初以来,信达提出了以创新为基石、走全球化的道路两大长期目标,旨在通过健康可持续的业务发展来支持和实现公司的长期发展战略。
为了实现这些目标,信达通过自主研发和商务拓展相结合,布局了25项临床试验和80多个临床前项目,涵盖肿瘤和非肿瘤领域。肿瘤领域包括实体瘤和血液肿瘤,非肿瘤领域则涵盖了三大慢性病领域:心血管代谢、自身免疫疾病以及眼科疾病。信达的技术平台包括单抗、多肽和小分子等传统技术,以及双抗、ADC、细胞治疗和siRNA等新型技术。为实现目标,信达生物在研发方面进行大力投资,在2022年,信达的研发投入达到了28.7亿元人民币,位列国内药企前十。公司的目标是在2027年实现年产品销售额达到200亿人民币。
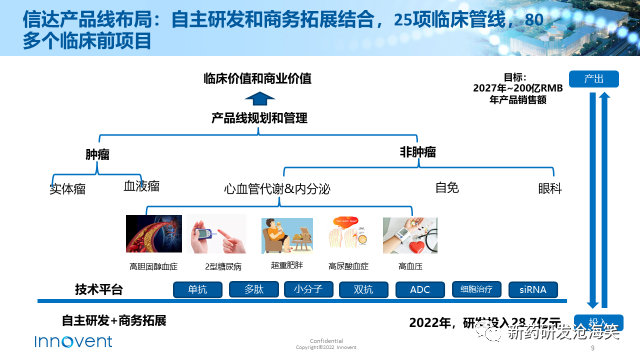
CVM是个很有市场潜力的治疗领域,也是我们接下来几年业务发展和增长的重要来源。我们对心血管代谢疾病领域的布局是基于多方面因素的综合考虑:包括患者人数、未满足需求以及信达的能力,包括研发、生产和商业化能力。我们选择了高脂血症、肥胖症、糖尿病、痛风、甲状腺眼病、高血压作为重点布局的方向。此外,还将拓展新适应症和进行生命周期管理,实现临床资源和科室协同,构筑长期竞争壁垒,旨在从根本上帮助患者进行疾病管理和预防。
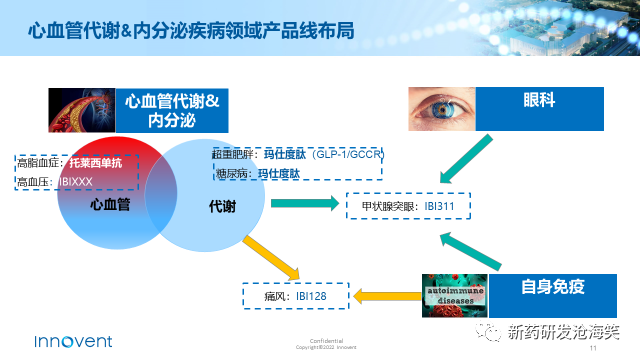
研发概况及进展
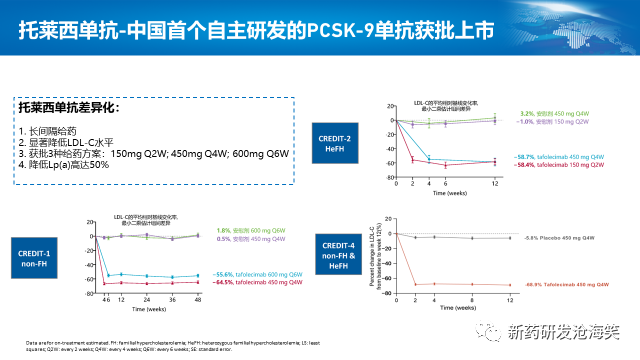
1)2023年8月,我们CVM领域的第一款产品,信必乐®获批。这是首个获批的国产原研PCSK9抑制剂,商业化团队已经在准备信必乐的正式上市。托莱西单抗具有给药间隔差异化、显著降低LDL-C和Lp(a)水平。获批3种给药方案:150mgQ2W, 450mg Q4W和600mg Q6W。托莱西单抗的3项关键注册临床研究CREDIT-1,CREDIT-2和CREDIT-4皆达成了首要终点和关键次要终点。无论是在非家族性高胆固醇血症、杂合子型家族性高胆固醇血症患者,3种给药方案皆显著降低LDL-C水平>55%。此外,托莱西单抗还显著降低Lp(a)水平高达50%。
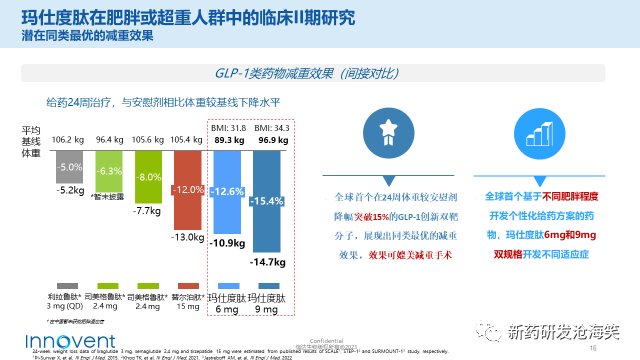
2)玛仕度肽(IBI362)是信达生物从礼来公司引进的GLP-1R/GCGR双靶激动剂,这一药物在全球范围内尚处于临床III期试验阶段,是信达生物心血管代谢领域的重点项目,具有巨大的潜力成为畅销药物。经过24周的GLP-1类药物治疗,间接对比显示,玛仕度肽(6mg)与安慰剂相比,体重下降的水平为12.6%,玛仕度肽(9mg)更是高达15.4%。相比之下,替尔泊肽为12.0%,司美格鲁肽为8.0%,利拉鲁肽为5.0%。玛仕度肽是全球首个在24周内体重较安慰剂降幅突破15%的GLP-1创新双靶分子,展现出同类最优的减重效果,可媲美减重手术。值得一提的是,玛仕度肽是全球首个基于不同肥胖程度开发个性化给药方案的药物,同时开发了6mg和9mg两种不同规格的适应症。这一创新性的个性化治疗方案,将为肥胖患者提供更多选择和更好的治疗效果。
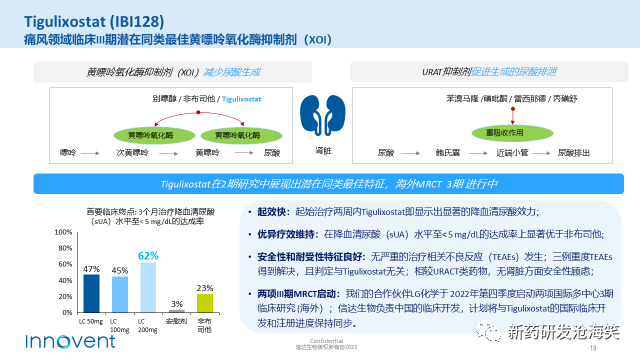
3)IBI128是信达生物从韩国LG化学引进的一种小分子黄嘌呤氧化酶抑制剂(XOI),这种抑制剂通过抑制尿酸的生成,有效降低尿酸水平。在最近的一项与非布司他进行的头对头对比的II期临床研究中,主要终点为在治疗3个月后将血清尿酸(sUA)水平降低至<5 mg/dL的达成率。令人欣喜的是,服用IBI128 200mg的受试者中,有高达62%的达成率,显著优于非布司他80mg的达成率23%。除此之外,IBI128在安全性方面表现优秀,与URACT类药物相比,它没有任何肾脏方面的安全性顾虑。这使得IBI128在痛风治疗领域具备了极大的潜力。它不仅可以显著降低尿酸水平,而且对肾脏功能无不良影响。可以预期,IBI128将成为痛风治疗领域的潜在同类最佳黄嘌呤氧化酶抑制剂(XOI)。目前,信达生物已启动了针对IBI128的中国临床试验,相信在不久的将来,它将会为痛风患者带来新的治疗选择。
4)目前,中国国内甲状腺眼病的治疗领域尚未有靶向药物获批,因此患者对于有效药物的可及性需求亟待满足。值得关注的是,中国唯一处于临床III期的抗IGF-1单抗——IBI311,针对的就是甲状腺眼病(TED)这一未满足的临床需求。在已经完成的II期临床研究中,IBI311展现出了快速的起效能力,患者在首次给药后即可实现眼突的显著缓解。同时,研究还观察到了具有临床意义的显著疗效信号,包括突眼和复视的改善。展望未来,IBI311将有可能解决中国甲状腺眼病患者所面临的巨大未满足需求,为他们带来新的治疗选择和更好的生活质量。我们期待着IBI311在临床III期试验中的进一步结果。
总结与展望:
产品线布局对于创新药企业至关重要,优化产品组合和布局、提升研发效率、增强市场竞争力、创造新的增长点、提高抗风险能力。信达生物,该公司一直以来都非常重视产品线布局,关注未满足需求和产品差异化,努力追求FIC和BIC。自2011年以来,信达生物持续投入研发,并取得了显著的成果。目前,信达生物已有十个分子获批上市,25项临床项目,80多条临床前管线。这些创新药的研发和上市,将进一步丰富信达生物的产品线,提升其在国内外市场的竞争力。
*本文转载自微信公众号 - - 新药研发沧海笑
相关文件下载、服务及学习课程:
合规文库:ICH Q11 药物的研发和生产(化学实体和生物技术产品/生物制品实体)
合规培训:药品注册必备知识点
委托定制:药品注册申请
联系专家,获取专家指导意见:e邀专家
*以上文章仅代表作者个人观点
 E邀专家
E邀专家























