 E邀专家
E邀专家
药品安全无小事,长期停产企业监管再强化
CIO专家-山丹
为深化药品生产领域的规范化管理,确保药品质量安全责任主体——药品生产企业严格遵循《中华人民共和国药品管理法》及《药品生产监督管理办法》的法定要求,四川省药品监督管理局于2024年7月2日针对性地发布了《关于加强长期停产药品生产企业监管工作的通知》(川药监办〔2024〕78号)。此通知紧密结合四川省药品生产的实际情况,精准施策,旨在细化并强化对企业停产与恢复生产流程的监管,全面系统地排查并消除潜在风险隐患,本文梳理了药企停产复产监督专项重点检查内容,新政下可供国内药企迎接飞检和自检自纠时参考。
一、各省药企停产复产政策全面概览
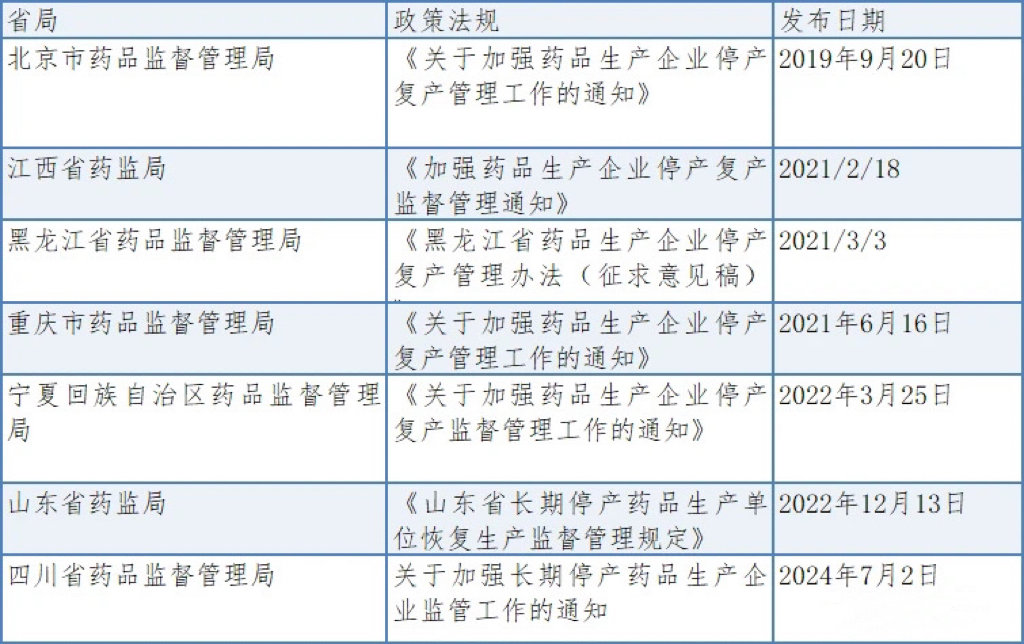
2020年3月30日,国家市场监督管理总局发布《药品生产监督管理办法》,自7月1日起实施,标志着药品监管进入新阶段。该办法对药企停产复产管理提出严要求,尤其是第46条明确了短缺药品停产报告制度。多地药监局如北京、江西、黑龙江、重庆、山东、宁夏及四川等已发布相关细则,要求药企在停产前需提前报告,非预期停产则须紧急通报,必要时还需上报国家药监局,以确保药品供应稳定及监管到位。具体要求如下表:
二、关于加强长期停产药品生产企业监管工作亮点抢先看
1. 停产时间界定
药品生产企业若计划连续停产6个月及以上,即达到了需要提交停产报告的门槛。这一时间界限的设定,旨在区分短期停产与长期停产,确保长期停产的企业能够提前做好相关准备和报告工作。
2. 停产报告时限
企业应在停产前30个工作日内向所在地药品监管部门提交报告。这一时间要求确保了监管部门有足够的时间审核报告内容,并在必要时采取相应措施,确保停产期间的药品安全和质量。
对于本通知印发前已经停产的企业(含生产线),应于本通知印发之日起30个工作日内补报。
3. 书面停产报告内容
停产报告需包含多项关键信息,包括但不限于:
(1) 更新后的场地管理文件:企业应提供最新的场地管理文件,以反映停产前的实际情况和未来的管理计划。
(2) 停产状态和时间信息:明确标注停产的具体时间和预计恢复生产的时间,以便监管部门掌握企业动态。
(3) 法定生产条件改变情况:如有任何影响药品生产的法定条件发生改变(如设施设备更新、生产工艺变更等),企业需在报告中详细说明。
4. 强化复产管理
在药品生产行业中,停产企业恢复生产是一个关键环节,需要严格的管理和审核流程以确保药品质量和安全。
(1) 全面自检:停产企业在拟恢复生产前,必须依据药品GMP(良好生产规范)进行全面的自我检查。自检内容包括但不限于生产设施、设备、人员、物料、工艺等方面的检查。
(2) 提交更新文件与说明:自检合格后,企业需向所在地药品监管部门提交更新后的场地管理文件。同时,企业还需对恢复生产情况进行单独说明,以便监管部门了解企业的恢复生产计划和准备情况。
(3) GMP符合性检查:对于整厂连续停产6个月及以上、无菌制剂生产线连续停产12个月及以上的情形,监管部门将组织开展药品GMP符合性检查。
(4) 避免重复检查:如果停产企业在恢复生产前,因原址或异地新建、改建、扩建车间(生产线)已经通过了相应的符合性检查,那么监管部门在复产时可不再重复进行这些检查。
5. 优化停产监管
为了更有效地管理药品生产企业的停产状态,确保监管资源的合理配置,对辖区内长期停产企业实施了分级分类监管策略。
(1) 整厂或部分生产线全年停产的监管:
对于整厂或部分生产线全年处于停产状态的企业,监管部门可以考虑不将其纳入当年的年度检查计划。这是因为,在停产期间,企业的生产活动已暂停,相应的风险也相对较低。因此,减少对这些企业的检查频次,既能节约监管资源,又能减轻企业的负担。
(2) 部分生产线长期停产但有生产计划的监管:
对于部分生产线长期停产但当年有生产计划的企业,监管部门应将其纳入年度检查计划,并在生产期间组织检查。这是为了确保企业在恢复生产前能够符合GMP等法规要求,保障药品质量和安全。通过在生产期间进行检查,监管部门可以及时发现并纠正潜在的问题,防止不合格药品流入市场。
(3) 长期停产且不再具备法定生产条件的处理:
对于长期停产且经现场核查不再具备法定生产条件的企业,药品监管部门应采取紧急控制措施,暂停其生产经营活动,并及时公告相关情况。这一措施是为了防止企业利用停产状态逃避监管,或在不符合法定条件的情况下擅自恢复生产。通过暂停生产经营和公告警示,可以保护消费者的权益,维护药品市场的秩序。
*本文来源 - - 智药公会微信公众号
相关文件下载、服务及学习课程:
合规文库:药品生产监督管理办法(2020年)
合规培训:药品GMP自检法规及要点解析
委托定制:GMP合规审计(符合性检查)
联系专家,获取专家指导意见:e邀专家
*以上文章仅代表作者个人观点。本文为转载文章,版权归原作者所有,如涉侵权,请联系我们删除。
 E邀专家
E邀专家




























