基本信息
1、办理部门:山东省药品监督管理局
2、办理方式:网上办理
3、办理地点:山东省济南市市中区站前路9号山东省政务服务中心1号楼3楼社会事务区C01窗口 - C01窗口
4、咨询电话:业务:0531-82083270,0531-51795666;领证:0531-82083270;0531-68966267 CIO咨询:400-003-0818
受理条件
根据《药品生产监督管理办法》(2020年1月国家市场监督管理总局令第28号公布)第六条,第十六条、第十七条的规定,申请人应当具备下列条件:变更《药品生产许可证》许可事项的,向原发证机关提出《药品生产许可证》变更申请,还应当符合国家制定的药品行业发展规划和产业政策,防止重复建设。未经批准,不得擅自变更许可事项。药品生产企业变更《药品生产许可证》登记事项的,应当在市场监督管理部门核准变更或者企业完成变更30日内,向原发证机关申请《药品生产许可证》变更登记。
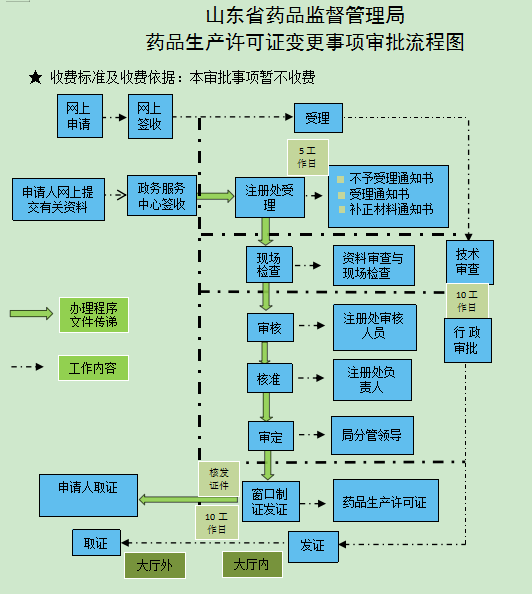
办理流程
流程文字说明
法定办结时限:15个工作日;承诺办结时限:10个工作日。
1、申请:0个工作日。
网络提交,申请人必须首先通过省局企业行政许可服务平台进行许可申报。
2、受理:5个工作日。
办理结果:获取受理(不予受理)凭证。
3、行政许可:20个工作日。
办理结果:获取审批决定书。
送达方式:窗口领取 邮寄送达。
申请材料
1、拟变更事项的基本情况,包括拟变更事项涉及的企业名称、生产线、生产品种、剂型、设备、工艺及生产能力(含储备产能)。
2、拟变更事项的场地、周边环境、基础设施等条件说明以及投资规模等情况说明。
3、组织机构图(注明各部门的职责及相互关系、部门负责人)。
4、拟变更企业厂区周边环境和总平面布置图、仓储平面布置图、质量检验场所平面布置图,并注明变更区域。
5、拟变更事项涉及生产车间概况,生产工艺布局平面图(包括更衣室、盥洗间、人流和物流通道、气闸等,并标明人、物流向和空气洁净度等级),空气净化系统的送风、回风、排风平面布置图,工艺设备平面布置图,并注明变更区域。
6、拟变更事项涉及的范围、剂型、品种、质量标准、注册进度。
7、拟变更事项涉及的生产剂型或品种的工艺流程图,并注明主要质量控制点与项目、共线生产情况。
8、拟变更事项涉及的空气净化系统、制水系统、主要设备确认或验证概况;生产、检验用仪器、仪表、衡器校验情况。
9、拟变更事项涉及的主要生产设备及检验仪器目录。
10、企业生产管理、质量管理文件目录。
11、受托方相关材料。
12、药品出厂、上市放行规程(原料药生产企业只提供出厂放行规程)。
13、疫苗的储存、运输管理情况,明确相关单位及配送方式(疫苗上市许可持有人提供)。
14、委托双方的基本情况,包括企业名称、拟生产品种、剂型、工艺及生产能力(含储备产能)。
15、拟委托生产的范围、剂型、品种、质量标准及依据(拟提交药品注册申请的药品标明注册进度)。
16、拟委托生产剂型及品种的工艺流程图,并注明主要质量控制点与项目、受托方共线生产情况。
17、生产管理、质量管理主要文件目录。
18、药品上市放行规程。
19、委托协议和质量协议。
20、持有人确认受托方具有受托生产条件、技术水平和质量管理能力的评估报告。
21、企业申请(用正式文件;内容至少包括申请原因、申请事项)。
22、跨省设立共用车间的,需提供中成药生产企业或车间所在地省级药品监督管理局审查意见。
23、所涉品种的药品注册证书、质量标准;中药提取物质量标准、工艺流程图、质量控制点。
24、申请方对共用车间的生产条件、技术水平和质量管理情况的考核报告。报告应至少包括以下内容:接受方的技术人员,厂房、设施、设备等生产条件和能力,以及质检机构、检测设备等质量保证体系能否满足提取物生产的需要。
25、共用车间合同:明确规定双方在中药提取物生产管理、质量控制等方面的质量责任及相关的技术事项,特别是要明确原辅料、包装材料的采购、检验和放行以及中药提取物检验、放行中双方各自的权利和义务,双方应共同建立对中药提取物生产活动的质量管理体系等内容,并符合国家有关药品管理的法律法规。
26、共用车间主要生产设备及检验仪器目录。
27、中药提取物所涉及的生产管理、质量管理文件目录。
28、拟变更的企业负责人的董事会决议或上级主管部门的任命文件;变更后企业负责人的简历、身份证(数据共享(系统自动获取,如数据不全则需申请者提交))。
29、拟变更的质量负责人的董事会决议或上级主管部门的任命文件以及变更后质量负责人的简历、学历、职称证书和身份证(数据共享(系统自动获取,如数据不全则需申请者提交))。
30、拟变更的生产负责人的董事会决议或上级主管部门的任命文件以及变更后生产负责人的简历、学历、职称证书和身份证(数据共享(系统自动获取,如数据不全则需申请者提交))。
31、拟变更的质量受权人的董事会决议或上级主管部门的任命文件以及变更后质量受权人的简历、学历、职称证书和身份证(数据共享(系统自动获取,如数据不全则需申请者提交))。
32、委托方《药品生产许可证》正本、副本。
33、生产地址文字性变更的,需提供生产地址文字性变更证明。
34、生产范围文字性变更的,需提交药品注册批件或其他证明材料。
35、凡提交申报材料时,经办人不是法定代表人本人的,应当提交经法定代表人签字并加盖企业公章的《授权委托书》。
36、生产地址文字性变更证明。
37、其他材料。
结果样本

常见问题
问题1:药品生产许可证载明事项有哪些?
答:第十五条 药品生产许可证载明事项分为许可事项和登记事项。
许可事项是指生产地址和生产范围等。
登记事项是指企业名称、住所(经营场所)、法定代表人、企业负责人、生产负责人、质量负责人、质量受权人等。
第十六条 变更药品生产许可证许可事项的,向原发证机关提出药品生产许可证变更申请。未经批准,不得擅自变更许可事项。
本办事指南摘自药监局官网,如有变动,以官方发布为准。