基本信息
1、办理部门:重庆市药品监督管理局
2、办理方式:窗口办理 网上办理 快递申请
3、办理地点:重庆市渝北区宝圣湖街道食品城大道27号重庆市药品监督管理局行政审批服务中心05-09号窗口
4、咨询电话:023-60353664 CIO咨询:400-003-0818
受理条件
1、申请事项属于本部门职权范围,申报资料齐全、符合形式审查要求。
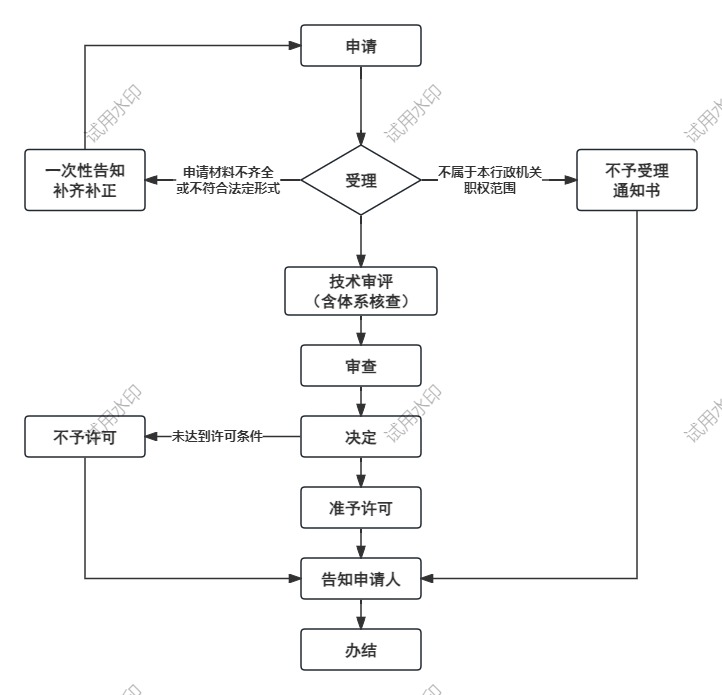
办理流程
流程文字说明
法定办理时限:20个工作日;承诺办理时限:7个工作日
1、受理(时限:0个工作日)
2、技术审评(时限:120个工作日)
3、审查(时限:5个工作日)
4、决定(时限:2个工作日)
5、颁证(时限:0个工作日)
申请材料
1、体外诊断试剂变更注册申请表;
2、临床评价资料;
3、产品说明书和标签样稿;
4、非临床资料;
5、质量管理体系文件;
6、监管信息;
7、综述资料。
结果样本

常见问题
问题1:注册变更相关规定?
答:依据《体外诊断试剂注册与备案管理办法》第七十八条 注册人应当主动开展体外诊断试剂上市后研究,对体外诊断试剂的安全性、有效性和质量可控性进行进一步确认,加强对已上市体外诊断试剂的持续管理。 已注册的第二类、第三类体外诊断试剂产品,其设计、原材料、生产工艺、适用范围、使用方法等发生实质性变化,有可能影响该体外诊断试剂安全、有效的,注册人应当向原注册部门申请办理变更注册手续;发生其他变化的,应当在变化之日起30日内向原注册部门备案。 注册证载明的产品名称、包装规格、主要组成成分、预期用途、产品技术要求、产品说明书、进口体外诊断试剂的生产地址等,属于前款规定的需要办理变更注册的事项。注册人名称和住所、代理人名称和住所等,属于前款规定的需要备案的事项。境内体外诊断试剂生产地址变更的,注册人应当在办理相应的生产许可变更后办理备案。 发生其他变化的,注册人应当按照质量管理体系要求做好相关工作,并按照规定向药品监督管理部门报告。
本办事指南摘自药监局官网,如有变动,以官方发布为准。






























