基本信息
1、办理部门:重庆市药品监督管理局
2、办理方式:窗口办理 网上办理 快递申请
3、办理地点:重庆市渝北区宝圣湖街道食品城大道27号重庆市药品监督管理局行政审批服务中心05-09号窗口
4、咨询电话:023-60353664 CIO咨询:400-003-0818
受理条件
1、申请事项属于本部门职权范围,申报资料齐全、符合形式审查要求。
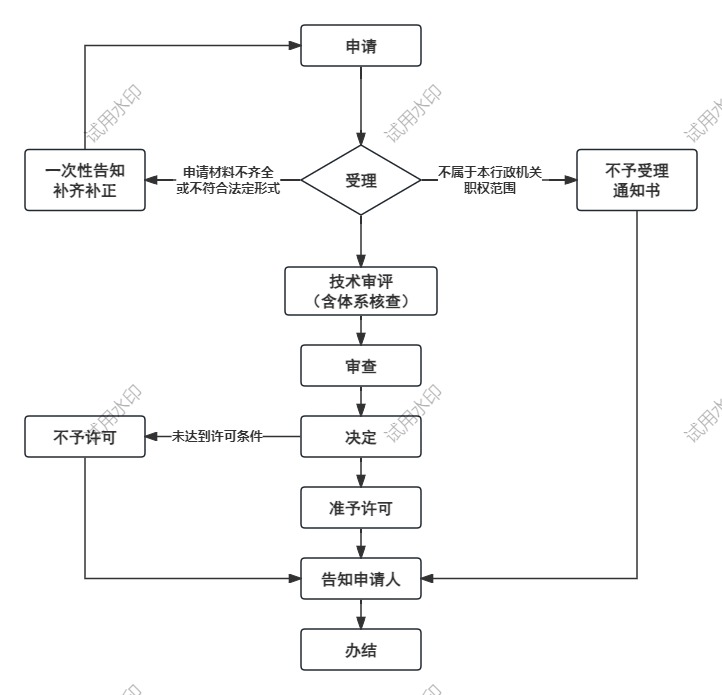
办理流程
流程文字说明
法定办理时限:20个工作日;承诺办理时限:7个工作日
1、受理(时限:0个工作日)
2、技术审评(时限:120个工作日)
3、审查(时限:5个工作日)
4、决定(时限:2个工作日)
5、颁证(时限:0个工作日)
申请材料
1、申请事项属于本部门职权范围,申报资料齐全、符合形式审查要求。第二类体外诊断试剂产品延续注册申请表;
2、临床评价资料;
3、监管信息;
4、非临床资料。
结果样本

常见问题
问题1:当延续注册产品有新的国家标准、行业标准发布,产品性能如何设计?
答:如医疗器械注册证有效期内有新的医疗器械强制性标准和/或国家标准品发布实施,已注册产品为符合新的强制性标准和/或国家标准品所做的变化属于应当办理变更注册的,注册人应当提交申请延续注册前已获得原审批部门批准的变更注册(备案)文件及其附件的复印件。已注册产品为符合新的强制性标准和/或国家标准品所做的变化属于无需办理变更注册手续或者无需变化即可符合新的强制性标准和/或国家标准品的,注册人应当提供情况说明和相关证明资料。
本办事指南摘自药监局官网,如有变动,以官方发布为准。






























