基本信息
1、办理部门:吉林省药品监督管理局
2、办理方式:窗口办理,网上办理,快递申请
3、办理地点:吉林省长春市南关区人民大街9999号吉林省政务服务中心B1层1-8号综合窗口
4、咨询电话:0431-82752980 CIO咨询:400-003-0818
受理条件
根据《医疗器械监督管理条例》第二十条规定及《体外诊断试剂注册与备案管理办法》相关要求,企业应填报《体外诊断试剂注册申请表》,并报送相关材料。要求企业申请材料齐全,符合法定形式;具备法人资格单位。
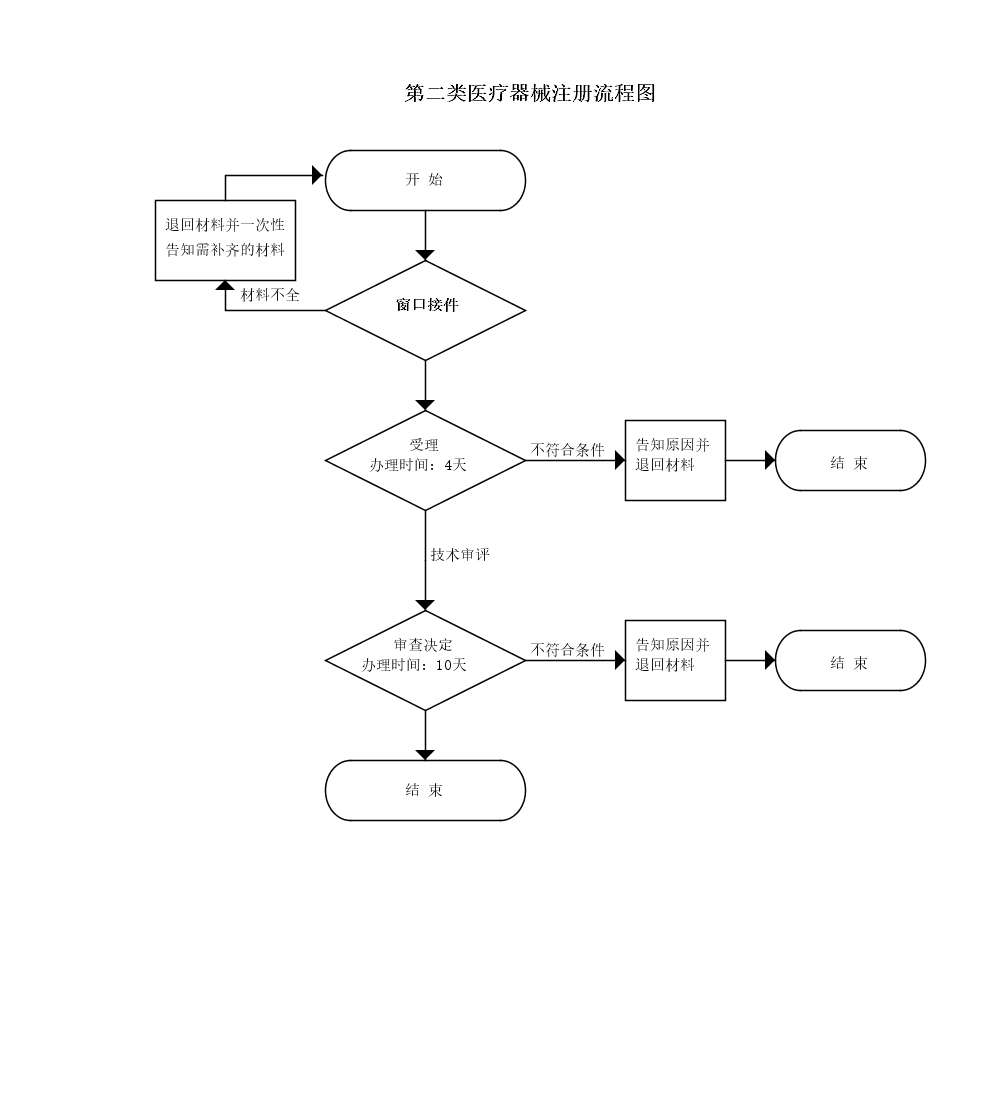
办理流程
流程文字说明
法定办理时限:20个工作日;承诺办理时限:14个工作日
1、受理(时限:4个工作日)
2、技术评审(时限:无)
3、审核决定(时限:10个工作日)
申请材料
1、监管信息-章节目录;
2、监管信息-申请表;
3、监管信息-术语、缩写词列表;
4、监管信息-产品列表;
5、监管信息-关联文件(注册申请人企业营业执照副本或事业单位法人证书,受托企业营业执照副本、委托生产协议、质量安全协议(如有));
6、监管信息-申报前与监管机构的联系情况和沟通记录;
7、监管信息-符合性声明;
8、综述资料-章节目录;
9、综述资料-概述;
10、综述资料-产品描述;
11、综述资料-预期用途;
12、综述资料-申报产品上市历史;
13、综述资料-其他需说明的内容;
14、非临床资料-章节目录;
15、非临床资料-产品风险管理资料;
16、非临床资料-体外诊断试剂安全和性能基本原则清单;
17、非临床资料-产品技术要求;
18、非临床资料-分析性能研究;
19、非临床资料-稳定性研究;
20、非临床资料-阳性判断值或参考区间研究;
21、非临床资料-其他资料;
22、临床评价资料-章节目录;
23、临床评价资料-临床评价资料;
24、产品说明书和标签样稿-章节目录;
25、产品说明书和标签样稿-产品说明书;
26、产品说明书和标签样稿-标签样稿;
27、产品说明书和标签样稿-其他资料;
28、质量管理体系文件-综述;
29、质量管理体系文件-章节目录;
30、质量管理体系文件-生产制造信息;
31、质量管理体系文件-质量管理体系程序;
32、质量管理体系文件-管理职责程序;
33、质量管理体系文件-资源管理程序;
34、质量管理体系文件-产品实现程序;
35、质量管理体系文件-质量管理体系的测量、分析和改进程序;
36、质量管理体系文件-其他质量体系程序信息;
37、质量管理体系文件-质量管理体系核查文件;
38、授权委托书-非法定代表人或企业负责人办理注册申请,需提供注册授权委托书;
39、非临床资料-检验报告。
结果样本

常见问题
问题1:行业标准提高修改产品技术要求是否属于许可事项变更,是否收费?
答:行业标准提高企业修改相应技术要求不属于许可事项变更,变更也不收费。
问题2:注册资料格式和内容能否详细说明?
答:详细的填写说明请参照《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》附件4(国家食品药品监督管理总局2014年第43号公告)执行。
本办事指南摘自药监局官网,如有变动,以官方发布为准。























