基本信息
1、办理部门:国家药品监督管理局
2、办理方式:窗口办理,网上办理,快递申请
3、办理地点:北京市西城区宣武门西大街28号大成广场3门1层
4、药监咨询:010-88331776(周三、周四全天) CIO咨询:400-003-0818
受理条件
申请注册的产品符合安全、有效、质量可控要求,注册申请人具有保证医疗器械安全、有效的质量管理能力。
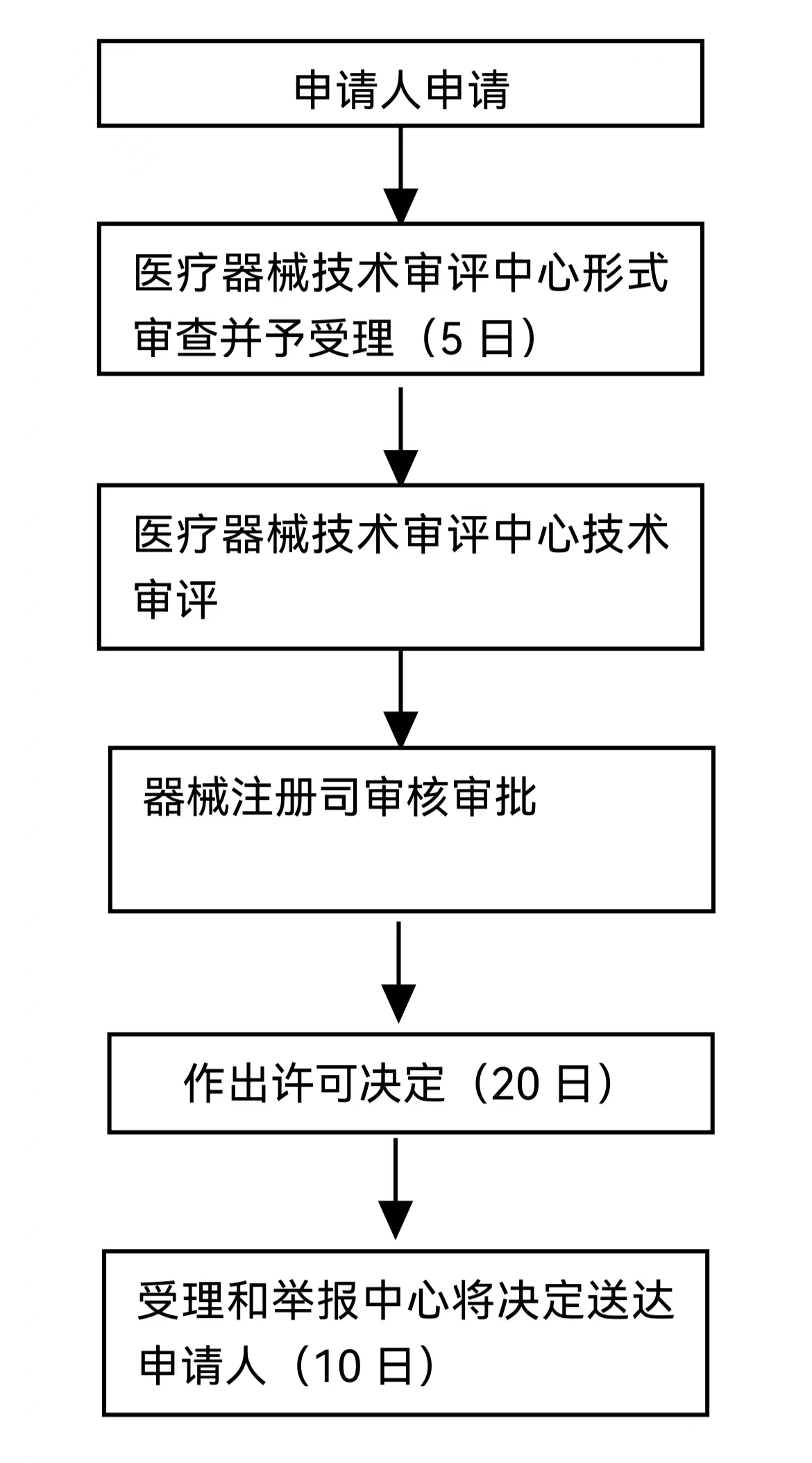
办理流程
流程文字说明
法定办结时限:20个工作日;承诺办结时限:5个工作日
1、申请人申请;
2、国家药品监督管理局受理/不予受理;
3、技术审评机构审评通过/不予通过(必要时,组织开展质量管理体系核查;对于拟作出不通过的审评结论的,申请人可以提出异议);
4、国家药品监督管理局注册/不予注册(必要时,开展现场勘验或组织听证);
5、送达。
申请材料
1、监管信息。
2、非临床资料。
3、临床评价资料。
结果样本



常见问题
问题1:如何准备临床评价资料?
答:行政相对人可参考《国家药监局关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告》(2021年第73号)准备临床评价资料。
本办事指南摘自药监局官网,如有变动,以官方发布为准。