基本信息
1、办理部门:国家药品监督管理局
2、办理方式:窗口办理,网上办理,快递办理
3、办理地点:北京市西城区宣武门西大街28号大成广场3门1层
4、药监咨询:010-88331576(周三、周四全天) CIO咨询:400-003-0818
受理条件
承担医疗器械临床试验的机构具备相应设备、专业人员等条件,该医疗器械的风险程度,临床试验实施方案,临床受益与风险对比分析符合要求。
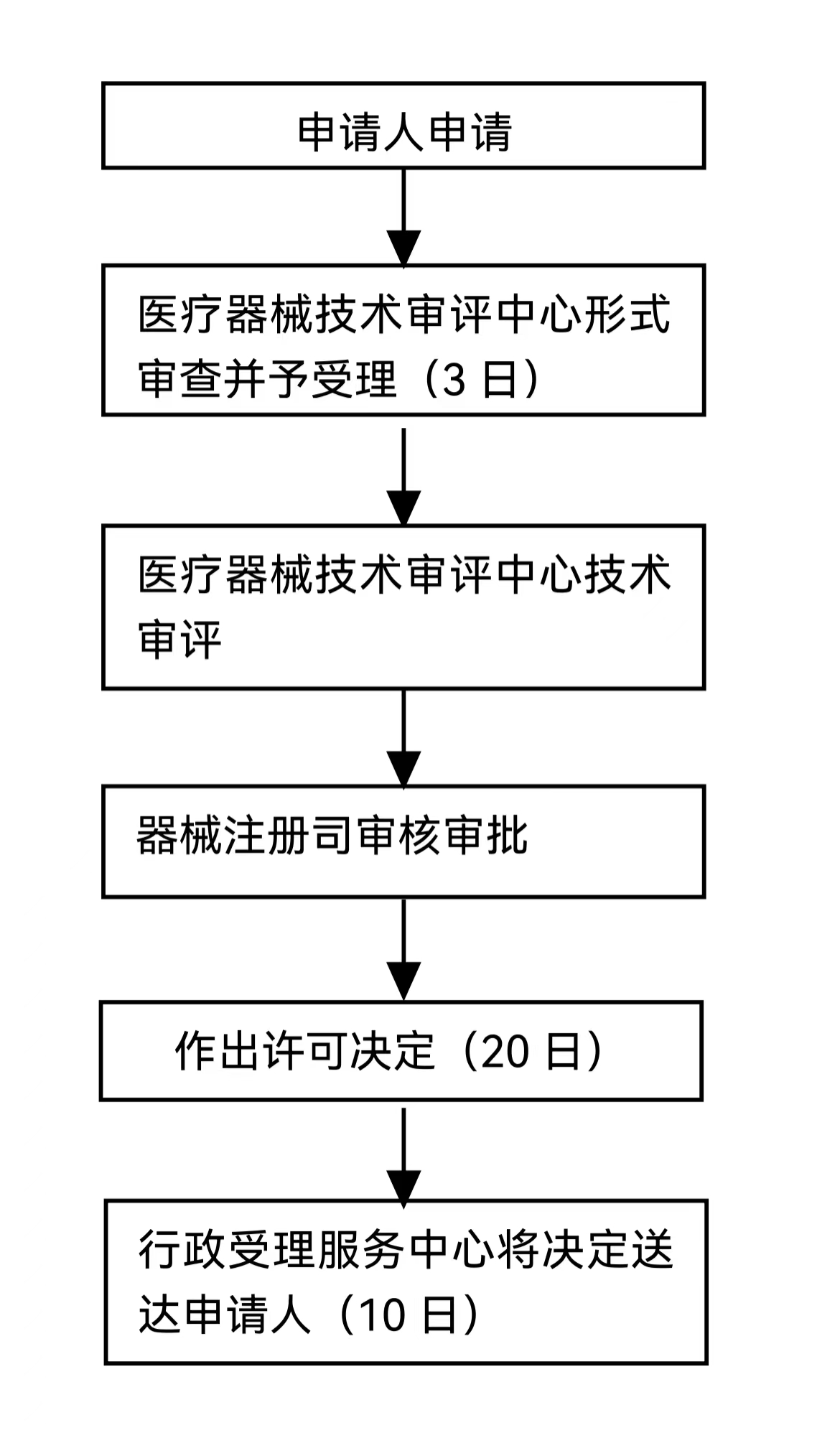
办理流程
流程文字说明
法定办结时限:60个工作日;承诺办结时限:5个工作日
1、申请人申请;
2、国家药品监督管理局受理/不予受理;
3、技术审评机构审评;
4、国家药品监督管理局同意/不予同意(必要时,组织听证)。
对于第三类高风险医疗器械临床试验审批决定由国家药品监督管理局医疗器械技术审评中心以国家药品监督管理局名义作出。
申请材料
1、综述资料。
2、研究资料。
3、临床资料。
4、产品说明书和标签样稿等。
结果样本

常见问题
问题1:临床试验申请人如何获知申请是否通过?
答:依据《医疗器械注册与备案管理办法》第四十条,由国家局器审中心网站通知申请人。
本办事指南摘自药监局官网,如有变动,以官方发布为准。