基本信息
1、办理部门:国家药品监督管理局
2、办理方式:窗口办理,网上办理
3、办理地点:北京大兴区华佗路31号(疫苗)、东城区天坛西里2号(体外诊断试剂)及指定的省级批签发机构所在地
4、药监咨询:大兴院区 010-53852424、天坛院区 010-67095260 CIO咨询:400-003-0818
受理条件
批签发申请人应当是持有药品批准证明文件的境内外制药企业。境外制药企业应当授权其驻我国境内办事机构或者我国境内企业法人作为代理人办理批签发。批签发申请人在每批产品销售前或者进口时,按照生物制品批签发管理办法的要求,提供相关文件进行生物制品批签发申请。
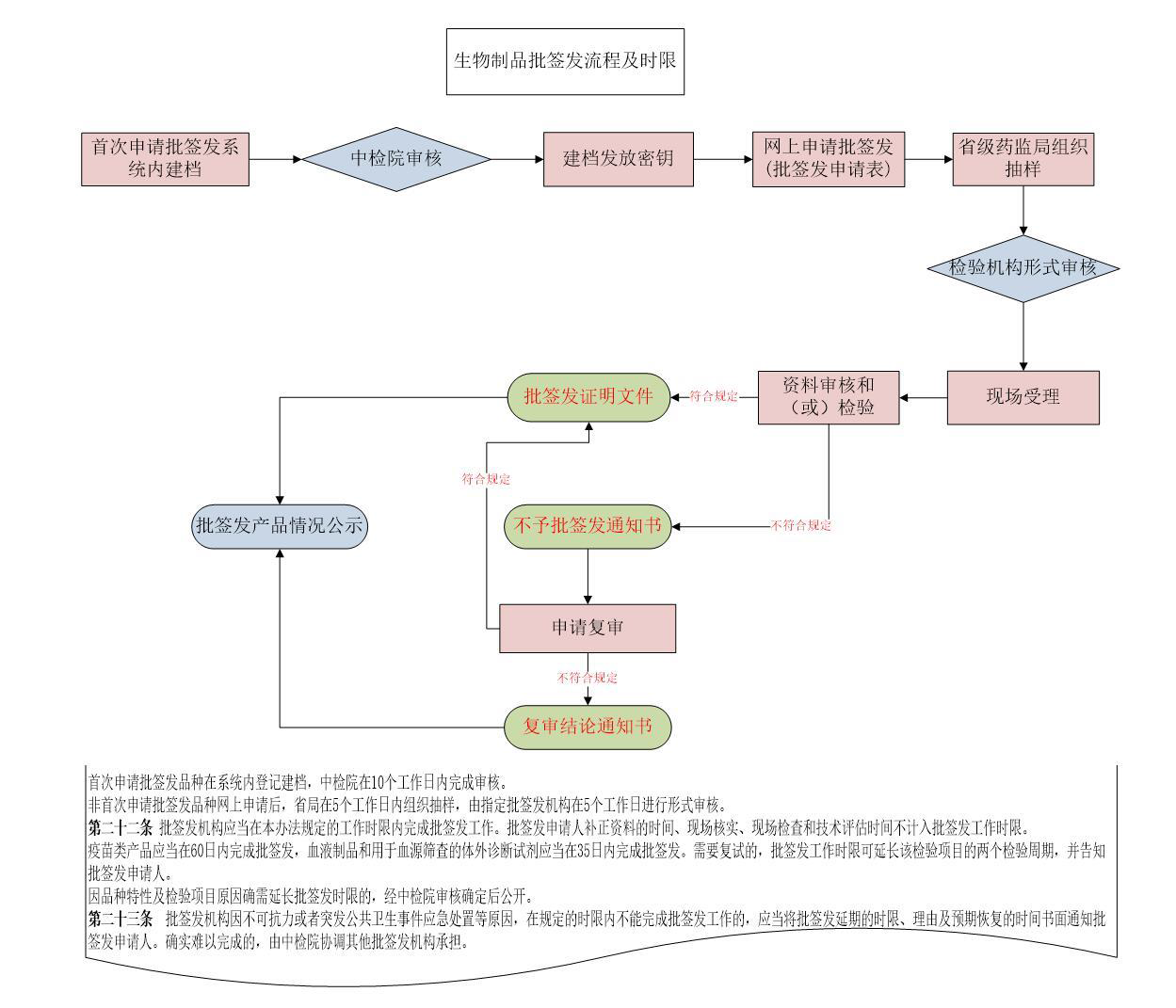
办理流程
流程文字说明
法定办结时限:60个工作日;承诺办结时限:3个工作日
1、申请人申请;
2、批签发机构受理/不予受理;
3、批签发机构开展资料审核和样品检验,可根据需要开展现场核实、现场检查;
4、出具生物制品批签发证明或生物制品不予批签发通知书;
5、送达。
申请材料
1、生物制品批签发申请表。
2、生物制品批签发现场抽样记录表。
3、批生产及检定记录摘要或全套制检记录。
4、药品批准证明文件。
5、合法生产的证明性文件。
6、上市后变更的批准证明性文件。
7、质量受权人等关键人员变动情况的说明。
8、进口产品同时提交生产企业所在国家或者地区的原产地证明以及药品管理当局出具的批签发证明文件。
结果样本

常见问题
问题1:申请批签发需要送检样品数量?
答:一般情况送检样品应为申请批签发的同批号产品,数量应该是一次检验用量的3倍。特殊情况下经中检院事先确认,可酌情减量,但不得少于检验用两倍量。必要时需提供与检验相关的中间产品、标准物质、试剂等材料。
本办事指南摘自药监局官网,如有变动,以官方发布为准。