基本信息
1、办理部门:国家药品监督管理局
2、办理方式:窗口办理,网上办理,快递申请
3、办理地点:(1)北京市朝阳区建国路128号;(2)北京市西城区宣武门西大街28号大成广场3门一层
4、药监咨询:注册受理咨询:010-85242306(周二、周四)或010-88331793(周一、周二全天);审评业务咨询:010-85243528(周一、周三、周五) CIO咨询:400-003-0818
受理条件
1、申请事项属于本行政机关职权范围,申请材料齐全、符合法定形式,或者申请人按照本行政机关的要求提交全部补正申请材料的,受理行政许可申请。
2、申请人应当为能够承担相应法律责任的企业或者药品研制机构等。境外申请人应当指定中国境内的企业法人办理相关药品注册事项。
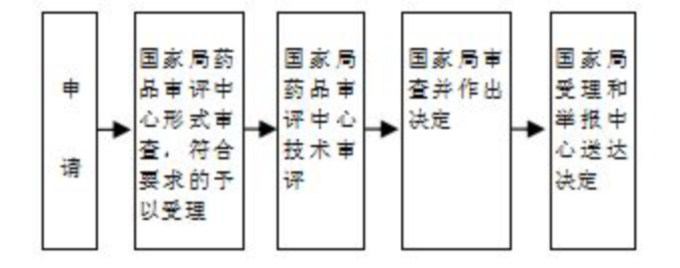
办理流程
流程文字说明
法定办结时限:20个工作日;承诺办结时限:5个工作日
1、受理;
2、技术审评;
3、注册核查(审评过程中基于风险启动);
4、注册检验(审评过程中基于风险启动);
5、综合评价;
6、行政审批;
7、行政许可决定;
8、制证送达。
申请材料
1、中药:上市许可申请表;
2、中药:①行政文件和药品信息;
3、中药:②概要;
4、中药:③药学研究资料;
5、中药:④药理毒理研究资料;
6、中药:⑤临床研究资料;
7、化药和生物制品:上市许可申请表;>>上市许可申请表
8、化药和生物制品:《M4:人用药物注册申请通用技术文档(CTD)》。
结果样本


常见问题
问题1:以药品为主的药械组合产品如何申报?
答:依据《关于药械组合产品注册有关事宜的通告》〔2009〕16号,申请人根据产品属性审定意见,以药品作用为主的药械组合产品,需申报药品注册,并在申请表中注明“药械组合产品”。同时,需按照《药品注册管理办法》、《医疗器械注册管理办法》等相关法律法规提交申报资料。
问题2:进口药品申报资料是否全部翻译为中文?
答: 根据《药品注册管理办法》,全部申报资料应当使用中文并附原文,其他文种的资料可附后作为参考。中文译文应当与原文一致。
问题3:关于按照生物制品管理的体外诊断试剂是否需申报临床试验申请?
答:按照生物制品管理的体外诊断试剂,申请人在境内完成临床试验后可以直接提出药品上市许可申请。
本办事指南摘自药监局官网,如有变动,以官方发布为准。