 E邀专家
E邀专家
黑龙江省药品监督管理局关于公开征求《黑龙江省第二类医疗器械优先审批程序(征求意见稿)》意见的函
各有关单位:
为贯彻实施黑龙江省委办公厅、省政府办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的实施意见》,省药监局《关于支持生物医药产业高质量发展若干措施》,优化医疗器械审评审批流程,鼓励创新,促进产业高质量发展,规范医疗器械飞行检查活动,加强医疗器械监督管理,根据原国家食品药品监督管理总局《医疗器械优先审批程序》《创新医疗器械特别审查程序》《药品医疗器械飞行检查办法》,黑龙江省药品监督管理局起草了《黑龙江省第二类医疗器械优先审批程序(征求意见稿)》《黑龙江省创新医疗器械审批程序(征求意见稿)》《黑龙江省医疗器械飞行检查管理办法(征求意见稿)》,现面向社会公开征求意见。
黑龙江省第二类医疗器械优先审批程序
(征求意见稿)
第一条 为保障黑龙江省医疗器械临床使用需求,推动我省医疗器械产业健康发展,根据《医疗器械监督管理条例》(国务院令第680号)、中办国办《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)、《医疗器械优先审批程序》(原国家食品药品监督管理总局公告2016年第168号)等有关规定,制定本程序。
第二条 省药品监督管理局(以下简称省局)对符合下列条件之一的本省辖区内第二类医疗器械注册申请实施优先审批:
(一)诊断或者治疗罕见病,且具有明显临床优势的医疗器械;
(二)诊断或者治疗老年人特有和多发疾病,且目前尚无有效诊断或治疗手段的医疗器械;
(三)专用于儿童,且具有明显临床优势的医疗器械;
(四)临床急需,且在本省尚无同品种产品获准注册的医疗器械,或虽在省内已有同类产品上市,但产品供应不能满足突发公共卫生事件应急处理需要的;
(五)列入国家、黑龙江省科技重大专项或国家、黑龙江省重点研发计划的医疗器械;
(六)黑龙江省战略性新兴产业骨干企业等黑龙江省重点扶持的医疗器械生产企业申请注册的医疗器械。
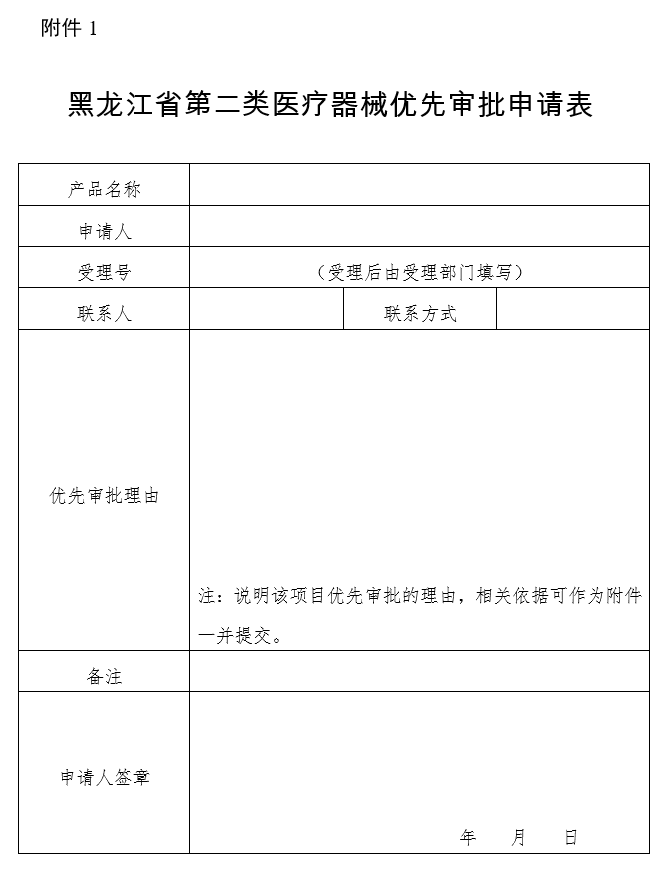
第三条 对于符合本程序第二条情形的,申请人应当在提交医疗器械注册申请时一并提交优先审批申请表(见附件1)。
对于本程序第二条第(五)、(六)项情形的医疗器械优先审批申请,申请人还应当提交相关证明文件。
第四条 省局医疗器械注册申请受理部门对优先审批申请材料进行形式审查,对优先审批申请材料齐全且予以受理的注册申请项目,注明优先审批申请。
第五条 对于本程序第二条情形的医疗器械优先审批申请,省局自收到申请之日起5个工作日内进行审核,符合优先审批情形的,出具审核意见,拟定予以优先审批。
第六条 省局将拟定优先审批项目的申请人、产品名称、受理号在其网站上予以公示,公示时间应当不少于5个工作日。公示期内无异议的,即优先进入审评程序,并告知申请人。
第七条 对公示项目有异议的,应当在公示期内向省局提交书面意见并说明理由(异议表见附件2)。省局应当在收到异议起10个工作日内,对相关意见进行研究,并将研究意见告知申请人和提出异议方。
第八条 经审核不予优先审批的,将不予优先审批的意见和原因告知申请人,并按常规审批程序办理。
第九条 对列入优先审批的医疗器械注册申请,省审核查验中心按照接收时间单独排序,优先技术审评、优先现场检查、优先临床核查。
第十条 对于优先审批的项目,省审核查验中心在技术审评过程中,应当按照相关规定积极与申请人进行沟通交流,必要时,可以安排专项交流。
第十一条 对于优先审批的项目,省审核查验中心在技术审评报告中注明为优先审批项目,省局优先进行行政审批。
第十二条 本程序由黑龙江省药品监督管理局负责解释,自发布之日起施行。
附件:
1.黑龙江省第二类医疗器械优先审批申请表
2.黑龙江省第二类医疗器械优先审批项目异议表

 E邀专家
E邀专家

最新推荐
黑龙江省药品监督管理局关于印发《黑龙江省药品监督管理局各监管领域2026年度日常行政检查计划》的通知 (黑药监法〔2026〕14号)
2026-01-28
关于公开征求《黑龙江省药品监督管理局支持化妆品产业高质量发展若干举措(征求意见稿)》意见的通知
2026-01-26
黑龙江省药品监督管理局关于发布桦褐孔菌药材质量标准的公告
2026-01-05
黑龙江省药品监督管理局公开征求《黑龙江省药品监督管理局行政处罚信息公示实施细则(修订稿)》意见
2025-12-25
黑龙江省药品监督管理局公开征求《黑龙江省药品监督管理局奖励药品领域市场主体内部人员举报重大违法行为实施办法(征求意见稿)》意见
2025-12-26
























