 E邀专家
E邀专家
2025年创新医疗器械获批名单:洞察我国医械产业创新发展的“风向标”
CIO专家-山丹
截至9月,我国在2025年共批准了55款创新医疗器械上市。这份名录不仅是新产品清单,更是洞察我国医械产业创新发展的“风向标”。

从名录中我们可以清晰地看到,我国医械创新已形成五大核心战场——“心-眼-脑-骨-癌”:
比如心血管领域已成为创新最活跃的领域,在2025年获批产品中占据重头,特别是在心脏脉冲电场消融这一前沿技术领域,多家企业的类似产品在短时间内密集获批,这也预示着该细分市场将面临激烈竞争。
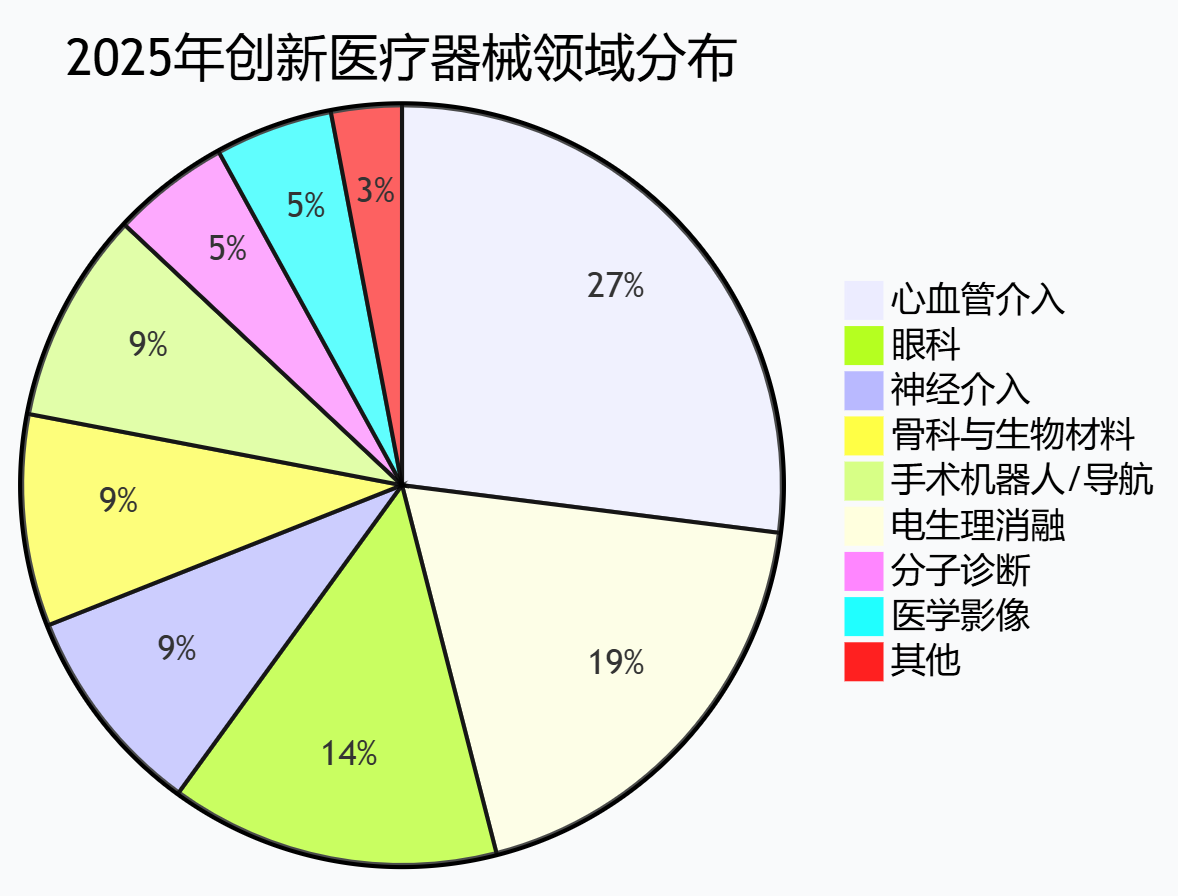

其次眼科领域的人工晶状体材料和设计的创新也尤为突出,从"交联聚异丁烯"到"焦深延长型",产品差异化十分明显。另外脑部、骨科、肿瘤等领域也有各自的创新突破。

这些趋势都说明出我国医械创新从跟跑到并跑,甚至在部分领域领跑的产业升级情况。
这也是政策导向和产业发展深度耦合的结果。
“创新医疗器械特别审查程序”为具有显著临床价值的创新产品开设"绿色通道"。2025年获批的创新器械,多数通过此路径加速审批,体现了国家鼓励实质性创新的政策导向。
个别地区,比如上海自2025年9月1日起实施的《上海市第二类创新医疗器械特别审查程序》,就为第二类创新器械提供了优先检测、优先审评、优先审批的服务,技术审评时限压缩至20个工作日内。
还有内蒙古2025年3月发布的创新医疗器械特别审查程序,实施"五优先"等区域性政策和国家层面的创新审评形成互补,为医械创新提供了更为灵活和高效的区域支持。
综合以上,我们也为医疗器械企业提供一些战略建议——
首先是产品研发方向:
1、创新医疗器械特别审查程序的核心要求是"具有显著临床价值"。企业应深入临床一线,识别现有疗法中未被满足的需求,比如手术效率提升、并发症减少、患者生活质量改善等。
2、从获批产品可见,材料科学、能量平台、人工智能与数字技术的交叉融合已经成为创新主旋律,企业应建立跨学科研发团队,在核心技术平台上构建产品矩阵。
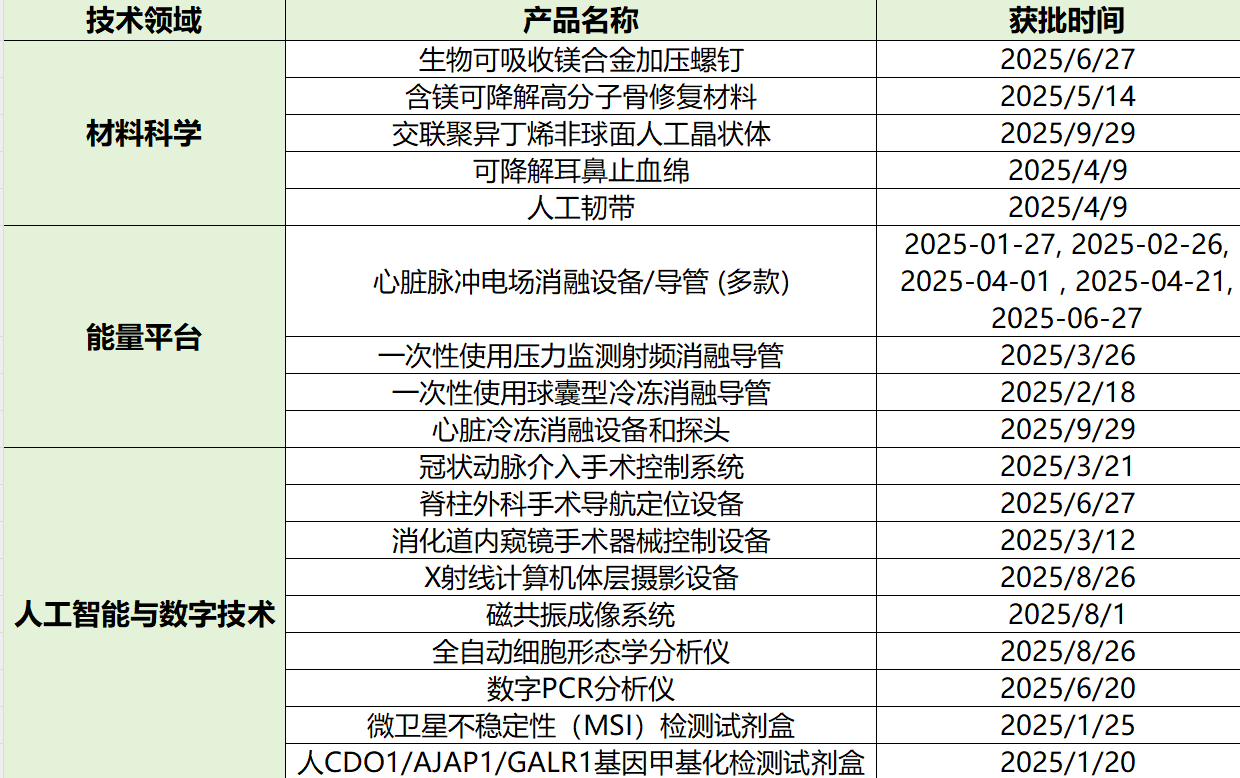
3、参考眼科人工晶状体的发展路径,推出首代创新产品时,就应规划后续技术迭代方向,建立持续创新的产品管线。
其次是政策红利:
1、善用国家和地方双轨政策,有重大技术突破的产品,瞄准国家创新医疗器械特别审查程序;具有区域特色或针对特定临床需求的产品,考虑利用地方创新通道(如上海的二类器械程序),享受审评时限压缩、优先检测等便利。
2、核心发明专利是进入创新通道的"入场券"。企业在研发立项初期就需要进行全面的专利布局。此外,在临床评价设计阶段就要开始准备证明其临床优势的证据链(与现有疗法的对比研究、临床终点选择、卫生经济学评价等)。

再者是市场调研和商业化:
1、在产品设计阶段就开展医生调研、患者需求分析,确保创新方向与市场接受度相匹配。
2、和顶尖临床中心共同开展临床研究,这不仅是注册审评的要求,也是产品优化、医生教育、市场推广的重要基础。
3、制定分阶段商业化路径,从确定首批市场,到积累临床数据,逐步扩张更广阔的市场。
·确定首批市场:聚焦对新技术接受度高的大型教学医院,建立标杆中心
·临床数据积累:通过真实世界研究持续积累临床数据,为医保谈判、适应症扩展奠定基础
·市场扩张:基于临床证据和专家共识,逐步向更广阔的市场渗透
4、创新产品上市后要充分考虑支付端接受度。前期可以探索和商业保险合作,同时为后续纳入医保目录准备充分的卫生经济学证据。
我国医械创新正从"数量增长"转向"质量提升"。企业只有真正把握"临床价值导向"的精髓,在各环节精准布局,才能在激烈的创新竞争中脱颖而出。
 E邀专家
E邀专家



























