 E邀专家
E邀专家
【药监头条】疫情期间,医疗器械应急审批该如何申报?广东省局给出这7项指引 !
自新冠肺炎疫情爆发以来,疫情防控用医疗器械需求量暴涨,其中医用口罩、防护服等在疫情防控最前线的用品出现了供应紧张的局面。
为应对新冠肺炎疫情,各地药品监管部门在加强质量监管的同时积极启动医疗器械应急审批的程序,3月6日,广东省药监局挂网出《关于印发医用口罩、医用防护服等疫情防控急需用器械应急审批申办指引的通知》,明确防控疫情所需医疗器械应急审批的工作要求。
作为具备疫情防控用品生产能力,愁于如何申报的企业,面对这次应急审批,我们该如何快速的申报并通过审批?这些工作要求最好先了解清楚。
对于申请应急审批首次注册的医疗器械,申请人应提供省级以上联防联控物资保障组或科技攻关组出具的意见,对医用口罩、医用防护服和红外体温测量设备可提供市级以上联防联控物资保障部门出具的应急审批情况说明。

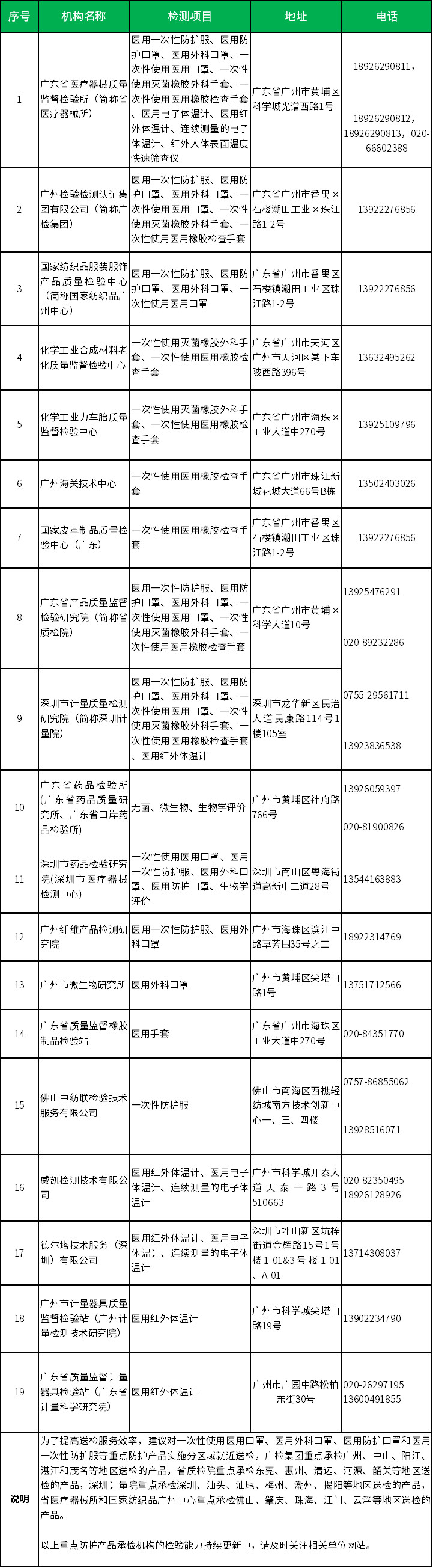
申请人可凭市工信部门或市场局出具的说明,向有资质的医疗器械检验机构申请全性能的应急检验。申请检验时,应向检验机构提供样品、产品技术要求和说明书。涉及“无菌”检验项目的,可在审评环节补交;涉及相关国家标准或行业标准中的生物性能要求,可基于原材料的生物相容性试验报告开展评价。

申请人提出应急注册申请的,向省药品监督管理局提交注册申报资料,具体要求见第二类医疗器械注册证核发办事指南(http://www.gdzwfw.gov.cn/portal/guide/11440000MB2D0344212440172015007)。医疗器械注册申请表中产品名称填写时应使用括号备注“疫情应急产品”,如:医用防护口罩(疫情应急产品)。申请资料第2项证明性文件中应同时提供关于应急审批的情况说明。
申请人应在注册受理后2个工作日内提交注册质量管理体系核查申请,具体要求见办事指南(http://www.gdzwfw.gov.cn/portal/guide/11440000MB2D0344212442072032000)。逾期未提交的,应急注册申请予以退回办结。申请人应在提交申请后5个工作日内接受现场检查,否则应急注册申请予以退回办结。
生产非无菌医用口罩、医用防护服的,应达到清洁生产环境要求。生产无菌医用口罩的,应具备不低于30万级生产环境洁净度级别,并提供相应的检测报告。生产采用辐照灭菌方式的无菌医用防护服的,应达到不低于清洁生产环境要求。申请人自身不具备检验能力的,可以委托具有同类产品检验能力的第三方检验机构或医疗器械生产企业开展。体系核查申请时应提供上述相应证明材料,并在申请前开展自查。
申请人应建立质量管理体系并保持有效运行,配备相应生产设备、人员、场地,具备生产管理和质量控制能力,保留相应记录,具体参见原国家食品药品监管总局2014年发布的《医疗器械生产质量管理规范》(http://www.nmpa.gov.cn/WS04/CL2138/299995.html)。
审评部门自收到材料之日起在2个工作日内组织开展现场检查。检查后涉及整改的,申请人应在10个工作日内提交整改报告,逾期未提交的,应急注册申请予以退回办结。注册质量管理体系核查未通过的,应急注册申请不予批准。
审评部门在组织现场检查后5个工作日内完成技术审评。审评过程需要申请人补充资料的,应当15个工作日内补充。逾期未补充的,应急注册申请予以退回办结。审评部门在收到补充资料后3个工作日内完成最终技术审评。
审批部门在技术审评和质量管理体系核查均完成后3个工作日内完成行政审批。
新冠肺炎全球确诊病例已过10万,波及80多个国家和地区,行动是当务之急。为此CIO合规保证组织发挥专业优势,推出医用防护服、体温计、医用口罩准入、生产、注册、备案等多种协助企业快速办理防疫物资的服务!
CIO合规保证组织与全国人民一起
打赢疫情防控战!
 E邀专家
E邀专家



























