2021年1-3季度广东省药品经营企业行政监管及监督检查情况分析
CIO专家-西洋参
一、2020年底我省药品经营企业基本情况概述:
2020 年度全省共有《药品经营许可证》持证企业 55610家。 其中以零售单体药店为主,共计 31848 家,占比 57.3%,批发企业 1483 家,占比 2.7%,零售连锁企业和门店共计 22279 家, 占比 40.1%。截至 2020 年 12 月底,全省零售连锁企业门店和零售单体店数 53672 家,占全省的 96.5%,从各区域上看,零售连锁企业门店数与单体店数之和前 5 位的地市为:东莞、广州、深圳、 佛山、惠州,五个地市总和占全省的 53%。
二、2021年1-3季度广东省药品经营企业存量异动情况分析表
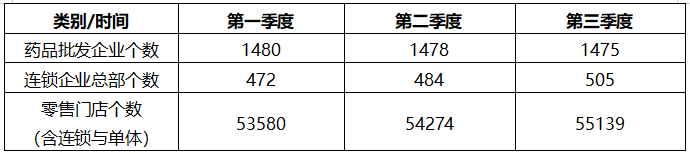
分析:从上述数据来看,今年第3季度我省批发企业总个数比2020年底要减少了8家,而全省零售连锁企业门店和零售单体店数却比2020年底增加了1467家,事实证明,人口密度大的城市如东莞、广州、深圳、 佛山等是零售门店增加的重点区域。
三、2021年1-3季度各级监管机构进行日常与专项检查情况分析表分析:
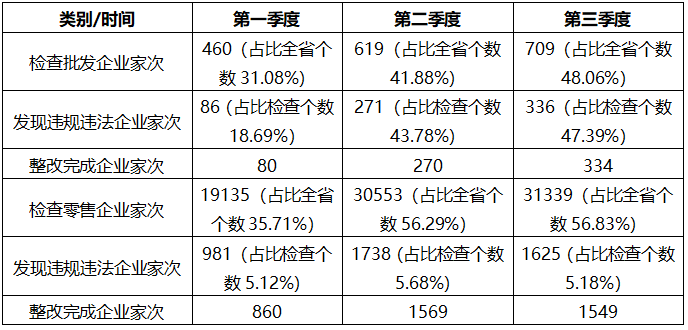
分析:从上述数据来看,批发企业发现违规违法企业家次要比零售企业比例高出许多,而第三季度批发企业发现的问题比例总量要比第一季度高出16.98%,呈上升趋势,而零售企业第三季度发现问题的比例总量几乎与第一季度持平。从整改情况来看,批发企业完成比例比较高,尤其是第2-3季度。第一季度批发企业整改完成比例是93.02%,第二季度整改完成比例是99.63%,第三季度整改完成比例是99.40%。第一季度零售企业整改完成比例是87.66%,第二季度整改完成比例是90.27%,第三季度整改完成比例是95.32%。
四、2021年下半年广东省药监局进行监督检查,发出风险控制情况分析表
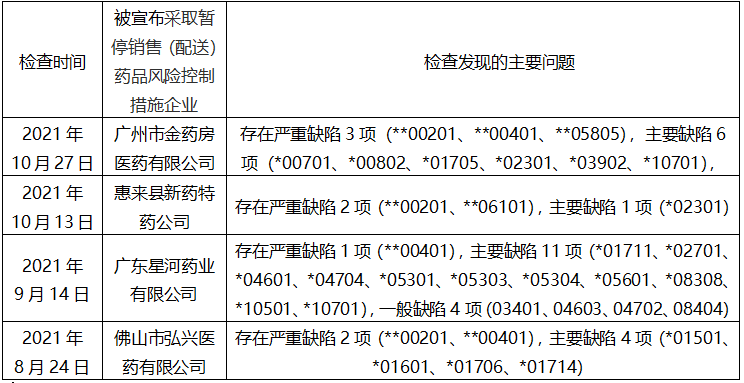
分析:以上四家批发企业在监督检查中发现存在严重违反《药品经营质量管理规范》规定,经综合评定可能存在药品质量安全隐患,根据《药品管理法》第九十九条及《药品检查管理办法(试行)》第六十二条规定,广东省药品监督管理局对上述企业采取暂停销售药品的风险控制措施,其中涉及到检查时GSP严重缺陷与主要缺陷相关条款的解读:
1. 严重缺陷**00201:企业应当在药品采购、储存、销售、运输等环节采取有效的质量控制措施,确保药品质量,并按照国家有关要求建立药品追溯系统;
2. 严重缺陷**00401:药品经营企业应当依法经营;
3. 严重缺陷**05805:企业计算机系统应当有符合《规范》要求及企业管理实际需要的应用软件和相关数据库;
4. 严重缺陷**06101:企业采购药品应当确定供货单位的合法资格;确定所购入药品的合法性;核实供货单位销售人员的合法资格。
5. 主要缺陷*00701:企业质量管理体系应与其经营范围和规模相适应,包括组织机构、人员、设施设备、质量管理体系文件及相应的计算机系统等;
6. 主要缺陷*00802:企业应当在质量管理体系关键要素发生重大变化时,组织开展内审;
7. 主要缺陷*01601:企业应当设立质量管理部门,有效开展质量管理工作;
8. 主要缺陷*01705:质量管理部门应当负责药品的验收,指导并监督药品采购、储存、养护、销售、退货、运输等环节的质量管理工作;
9. 主要缺陷*01706:质量管理部门应当负责不合格药品的确认,对不合格药品的处理过程实施监督;
10. 主要缺陷*01711:质量管理部门应当组织验证、校准相关设施设备;
11. 主要缺陷*01714:质量管理部门应当组织质量管理体系的内审和风险评估;
12. 主要缺陷*02301:从事质量管理、验收工作的人员应当在职在岗,不得兼职其他业务工作;
13. 主要缺陷*02701:企业应当按照培训管理制度制定年度培训计划并开展培训和考核,使相关人员能正确理解并履行职责;
14.主要缺陷*03902:记录应当真实、完整、准确、有效和可追溯;
15. 主要缺陷*04601:库房的规模及条件应当满足药品的合理、安全储存,便于开展储存作业;
16. 主要缺陷*04704:库房应配备自动监测、记录库房温湿度的系统;
17. 主要缺陷*05301:企业应当按照国家有关规定,对计量器具、温湿度监测设备等定期进行校准或检定;
18. 主要缺陷*05303:企业应当对储运温湿度监测系统进行使用前验证、定期验证和停用时间超过规定时限的验证;
19. 主要缺陷*05304:企业应当对冷藏运输等设施设备进行使用前验证、定期验证和停用时间超过规定时限的验证;
20. 主要缺陷*05601:企业应当根据验证确定的参数及条件,正确、合理使用相关设施设备
21. 主要缺陷*08308:药品堆码垛间距不小于5厘米,与库房内墙、顶、温度调控设备及管道等设施间距不小于30厘米,与地面间距不小于10厘米;
22. 主要缺陷*10501:在冷藏、冷冻药品运输途中,应当实时监测并记录冷藏车、冷藏箱或者保温箱内的温度数据;
23. 主要缺陷*10701:企业委托其他单位运输药品的,应当对承运方运输药品的质量保障能力进行审计,索取运输车辆的相关资料,符合《规范》运输设施设备条件和要求的方可委托。
相关文件下载、服务及学习课程:
合规文库:药品经营质量管理规范 (GSP)
合规培训:医疗器械经营质量管理实施要点培训
合规服务:GSP合规审计
联系专家,获取专家指导意见:e邀专家
最新推荐
热门观点

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

医疗机构制剂注册备案
1.CIO为医疗机构配制制剂提供一站式合规服务。 2.帮助医疗机构取得医疗机构制剂注册批件。 3.价格合理,服务更省心。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

医疗器械互联网信息服务备案
自2025年1月20日起,国家药监局将“药品、医疗器械互联网信息服务审批”改为备案管理。我们为自建网站或平台销售医疗器械的企业提供专业的医疗器械互联网信息服务备案咨询服务,帮助企业高效完成备案。

药品互联网信息服务备案
自2025年1月20日起,药品和医疗器械互联网信息服务审批不再需要前置审批,转而实行备案管理。我们致力于为药企提供高效、专业的药品互联网信息服务备案服务,帮助客户顺利开展网络销售业务。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。






