基本信息
1、办理部门:国家药品监督管理局
2、办理方式:网上办理,现场办理
3、办理地点:北京市朝阳区建国路128号;北京市西城区宣武门西大街28号大成广场3门一层
4、药监咨询:010-85242306或010-88331793 CIO咨询:400-003-0818
受理条件
申请事项属于本行政机关职权范围,申请材料齐全、符合法定形式,或者申请人按照本行政机关的要求提交全部补正申请材料的,受理行政许可申请。 申请人应当为能够承担相应法律责任的企业或者药品研制机构等。境外申请人应当指定中国境内的企业法人办理相关药品注册事项。
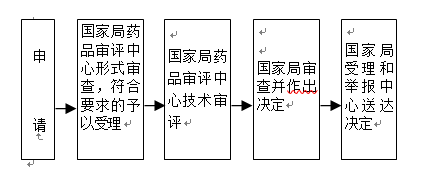
办理流程
流程文字说明
1、受理:受理人员对申请材料进行形式审查。申请事项依法不需要取得行政许可的,即时告知申请人不受理;申请事项依法不属于本行政机关职权范围的,即时作出不予受理的决定,并告知申请人向有关行政机关申请;申请材料存在可以当场更正的错误的,允许申请人当场更正;申请材料不齐全或者不符合法定形式的,当场或者在五日内一次告知申请人需要补正的全部内容,逾期不告知的,自收到申请材料之日起即为受理;申请事项属于本行政机关职权范围,申请材料齐全、符合法定形式,或者申请人按照本行政机关的要求提交全部补正申请材料的,受理行政许可申请。
2、应在200日内完成技术审评,其中优先审评审批程序的审评时限为130日,临床急需境外已上市罕见病用药优先审评审批的审评时限为70日。在技术审评过程中需要申请人补充新的技术资料的,申请人应当在80日内按照通知要求一次性完成补充资料;不需要补充新的技术资料,仅需申请人对原申报资料进行解释说明的,申请人应在5日内按要求提交相关解释说明。进入特殊审批程序的,按照特殊审批程序的要求办理。
3、行政审批决定应当在20日内作出;根据《药品上市许可优先审评审批工作程序(试行)》,对于纳入优先审评审批程序的品种,行政审批决定应当在10日内作出。
4、送达:自行政许可决定作出之日起10日内,NMPA受理和举报中心将行政许可决定送达申请人。
申请材料
1、境内生产药品注册 –上市许可申请表;
2、申报资料自查表;
3、M4:人用药物注册申请通用技术文档(CTD)。
常见问题
问题1:对于FDA批准的新剂型产品(505b2途径),且橙皮书显示该产品为RLD和RS,如申请进口注册,应按5.1还是5.2类申报?
答: 按照当前法规,此类情形可按5.1类进行申报。
问题2:药品申报资料中临床试验报告的封面有哪些要求?
答: 应符合《国家药品监督管理局关于发布化学药品注册受理审查指南(试行)的通告》((2020年第10号)的要求,临床试验报告应符合相关指导原则要求。临床试验报告标题页应提供药品注册申请人(签字及盖章),主要或协调研究负责人(签字)、复核或协调研究单位名称、统计学负责人(签字)和统计单位名称及ICHE3要求的其他信息;临床研究报告附录II中应提供申办方负责医学专员签名。
本办事指南摘自药监局官网,如有变动,以官方发布为准。