 E邀专家
E邀专家
55款创新药背后的启示:肿瘤赛道“内卷”,企业如何凭四大策略突围?
CIO专家-山丹
2025年前3季度,国家药监局共批准了55款创新药上市。立足清单,今天重点和大家谈“附条件批准”如何改变研发策略,以及“肿瘤赛道内卷下的破局之道”。

一、“附条件批准”成为加速创新药可及性的关键
首先,清单明确标注“附条件批准”的药品多达10个,这些药品通常是在二期临床中有突出疗效,基于替代终点或中间临床终点数据,提前获批上市的。

这表明国家药监局在以临床价值为导向的审评审批改革中,对严重危及生命且尚无有效治疗手段的疾病开辟了高效的“绿色通道”。
这一趋势也强烈鼓励药企聚焦于真正的临床未满足需求,比如罕见肿瘤、特定耐药突变、或无标准治疗晚期患者的药物。对于投资者和研发机构而言,选择具有突破性潜力的靶点和适应症,更容易获得政策红利,加快商业化回报。
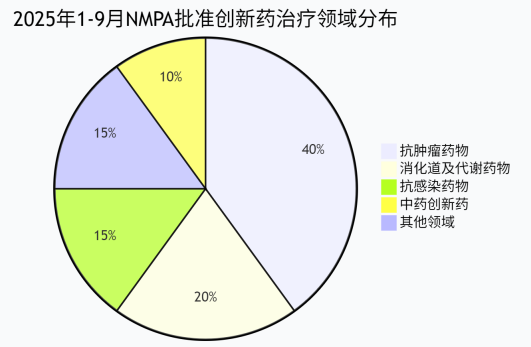
二、肿瘤为王,赛道内卷下的破局之道
清单中超过一半的批文是抗肿瘤药。这说明了我国肿瘤患者巨大的未满足需求,也意味着热门靶点(如HER2、CDK4/6)赛道将异常拥挤。企业破局的关键在于从同质化竞争转向差异化生存,核心策略有四:
一是技术,当小分子药物扎堆时,技术平台可以向抗体偶联药物、细胞治疗和双特异性抗体等前沿领域研发。二是策略,深耕基于生物标志物的细分人群,虽目标患者群缩小,但能凭借无可替代的临床价值在细分赛道领先。三是场景,竞争焦点不要局限单一药物,学会主动布局联合疗法、探索在新辅助/辅助治疗等更前线场景的应用,能极大拓展产品的市场空间和生命周期。四是生态,最终竞争是综合实力的比拼,比如强大的商业化能力能渗透市场,国际化出海能反哺研发,那“药+诊断”的一体化则能精准锁定目标患者,形成闭环。
五年前我们还在讨论Me-too,今天已经看到了Best-in-class甚至First-in-class的苗头。相信随着这批创新药进入市场并产生临床价值和商业回报,我国将从‘制药大国’稳步迈向‘制药强国’。
更多创新药研发上市问题,欢迎联系我们。
 E邀专家
E邀专家



























