 E邀专家
E邀专家
制药企业需严守质量底线、做好GMP检查,否则将面临“天价”罚单
CIO专家-秦艽
日前,某知名药企因违反《药品管理法》、生产销售多个批次的不合格药品而被北京市监部门责令停产停业整顿30天、没收违法所得618万余元及涉案药品5.4万余盒,并罚款1.34亿余元。这一事件引起了社会的广泛关注,为制药行业敲响了警钟。作为医药领域的一份子,我们深知药品质量对于公众健康的重要性。该事件让我们看到,药品生产企业的责任重大,任何疏忽都可能对消费者的健康带来严重威胁。因此,制药企业应当从这一事件中吸取教训,严格遵守药品相关的法律法规,始终坚守质量安全底线。各企业应当严格按照GMP从事生产活动,把控好出厂药品的质量;因故被暂停生产或责令停产、需恢复生产的,更是应该做好准备、迎接GMP检查。
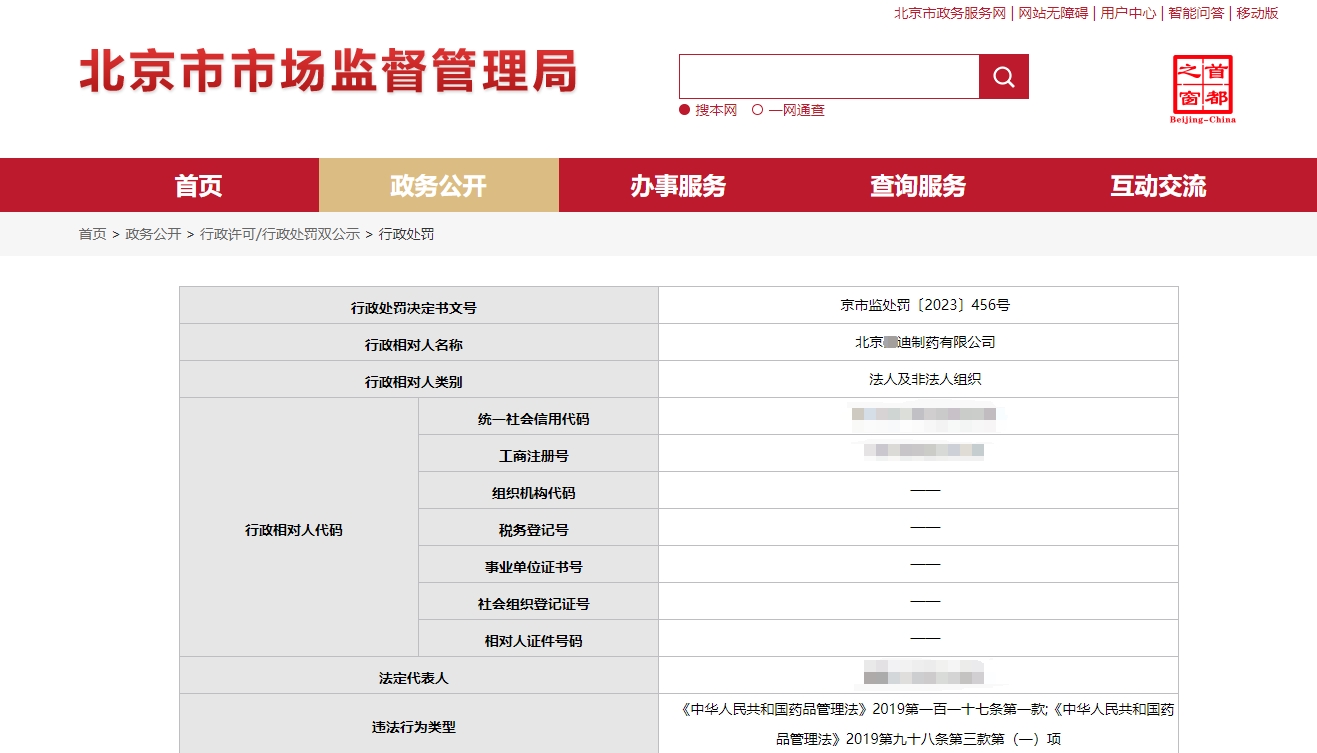
据国家药监局发布的通告显示,北京*迪制药自行及委托生产的多个批次产品被检测出不合格,涉及的产品包括碳酸钙D3颗粒、碳酸钙D3颗粒(Ⅱ)和碳酸钙D3片(Ⅱ)。
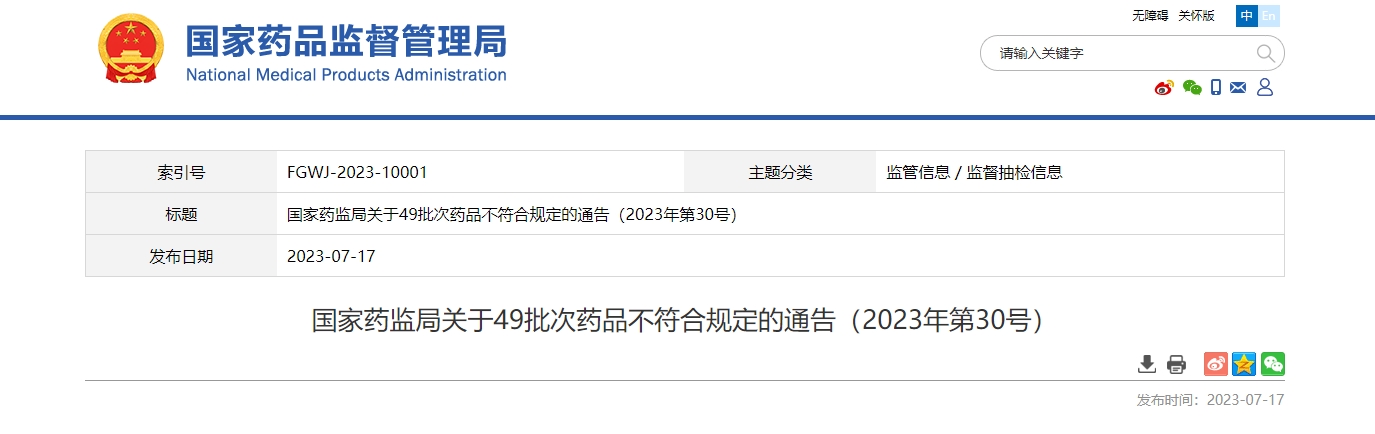
上述产品的不合格项均为维生素D3的含量测定不符合相关标准的规定,按照《药品管理法》的定义可将这些产品列为劣药。根据《药品管理法》第一百一十七条规定:“生产、销售劣药的,没收违法生产、销售的药品和违法所得,并处违法生产、销售的药品货值金额十倍以上二十倍以下的罚款。”此次事件中的企业被开出“天价”罚单也并非难以理解。上述32批次的药品共计生产了93万余盒,尽管后续累计召回了5.4万余盒,但实际销售金额仍高达618万余元。该品牌连续多年进入钙制剂销售榜前列,此次涉案产品之多,足以影响到大范围的使用人群。7月19日,该药企发布官方声明称:“经第三方权威专家认证,维生素D3易因气温、运输等客观环境因素造成含量不稳定,但不会对人体造成伤害。”
万幸的是,药品中维生素D3含量略低并不会损伤使用者的身体健康,但这一事件还是暴露了制药企业在生产过程中的一些问题,包括但不限于原材料控制、生产流程、质量控制等方面存在着一定的漏洞与不足。因此,企业严格遵守GMP来进行生产是十分必要的。GMP全称为《药品生产质量管理规范》,旨在确保药品生产过程中的安全性和有效性,适用于药品生产的全过程。同时,GMP检查则是保证药品质量的重要手段之一,它包括对药品生产企业的设施、设备、人员、文件记录等方面的检查,以确保企业符合规范要求。然而,除了此次的事件之外,近期也有多家药企因生产劣药而遭受不同程度的处罚。由此我们不难得知,一些制药企业在GMP检查中可能存在形式主义和走过场的情况,导致一些问题被忽略或掩盖。
综上,制药企业应当做到以下几点。
一、严格遵守GMP要求,认真对待每一个环节和细节。企业应当建立完善的GMP管理体系,明确各个环节的责任和标准操作流程。在生产过程中,要严格执行各项规定,确保产品质量符合标准。同时,对于GMP检查中发现的问题要及时整改和追责,防止类似问题再次发生;对于不合格的产品要立即进行召回和处置,防止问题产品流入市场。
二、加强内部管理,提高员工素质和责任意识。药品生产过程中涉及到许多环节和流程,任何一个环节的疏忽都可能导致药品质量问题。同时,人员其实也是GMP检查过程中的一个重点项目。因此,制药企业应当建立完善的内部管理制度,明确各个部门和岗位的职责和权限,确保每一个员工都清楚自己的职责所在。此外,要加强对员工的日常培训和教育,提高他们的责任意识和质量意识,确保他们在工作中能够严格按照要求执行。
对于制药企业而言,药品的质量就是生命线。合规生产不仅仅是一种法律要求,更是一种社会责任和企业形象的体现。企业不能抱有侥幸心理,以为可以通过规避监管或偷工减料来获得短期利益。我们应当从近期的这类事件中吸取教训,共同维护好药品质量,守护好公众的生命健康。倘若企业在GMP检查方面存在疑问,欢迎联系专业的第三方咨询服务机构,我们将为您的企业合规生产提供切实可行的建议。
相关文件下载、服务及学习课程:
合规文库:药品生产质量管理规范
合规培训:GMP飞行检查准备及应对策略
委托定制:GMP合规审计(符合性检查)
联系专家,获取专家指导意见:e邀专家
*以上文章仅代表作者个人观点
 E邀专家
E邀专家




























