 E邀专家
E邀专家
拥抱GSP远程审计,湖北药监局发布药品经营活动非现场检查指南
CIO专家-元参
近日,湖北省药监局发布关于公开征求《湖北省药品经营活动非现场检查指南(试行)》意见的通知,检查指南中列举了采用非现场检查方式的目的、适用范围、准备和实施。接下来让CIO合规保证组织小编带大家了解非现场检查对药品经营企业的影响,介绍非现场检查和GSP远程审计的联系。
一、为什么推行非现场检查?
通知里对非现场检查的定义:
为确认药品经营活动合规性、药品经营质量管理规范(以下简称药品GSP)以及社会药房质量和服务管理指南(以下简称药品GPP)符合性,通过文件审核、视频调查或混合检查等,采用远程评估方式实施的药品经营活动检查方式。
以前药监部门会到药品经营企业进行日常监督现场检查,但是现场检查有几个局限,一是像COVID-19不可抗力因素会造成现场监督检查人员人身和健康风险,二是对于体量大门店多的零售企业,迎接检查产生的经济负担和监督检查派出部门的经费投入很大,为了提高监督检查的灵活性,推行非现场检查势在必行。
二、哪些情况适用非现场检查?
(一)因健康风险等危机因素不能实施现场检查的。
(二)被检查经营企业或场地具有较好的药品GSP和药品GPP合规历史,但存在以下情形需要开展检查的:
1.药品委托销售、储存、运输,或涉及多个经营场地(如连锁门店、多仓协同等)需实施延伸检查或联合检查的;
2.因药品经营许可变更、延续等不能完全根据书面资料审核,而需要核实有关问题的;
3.药品监督抽查、疫苗流通巡查中可以采取非现场方式的。
(三)必要时,可采取混合检查方式。因非现场检查的局限性,不能完全替代现场检查,基于风险评估联合属地药品监管部门派出1-2名检查员到被检查场地,按照非现场检查方案要求对有关问题进行现场核实的,即为混合检查方式。
三、开展非现场检查要准备什么?
开展非现场检查需要做好好两方面的准备工作,一是非现场检查计划管理,二是非现场检查通信设施要求。
(一)非现场检查计划至少包含以下内容:
1.检查对象及启动原因;
2.分阶段检查时间及其安排;
3.检查组成员,包括是否需要采取混合检查方式。
(二)非现场检查应至少具备以下通信设施条件:
1.设立视频会议平台的会议室。
2.提供经营活动操作、设施和设备的实时视频。
3.具备适当的电子文件和信息交换平台。
4.如被检查企业可以提供实时摄像机镜头或视频记录进行远程审查有关药品经营单元操作、设备设施和相关文件的,则有限的现场检查应视为非现场检查的一部分,且应录制、保留相关视频资料。
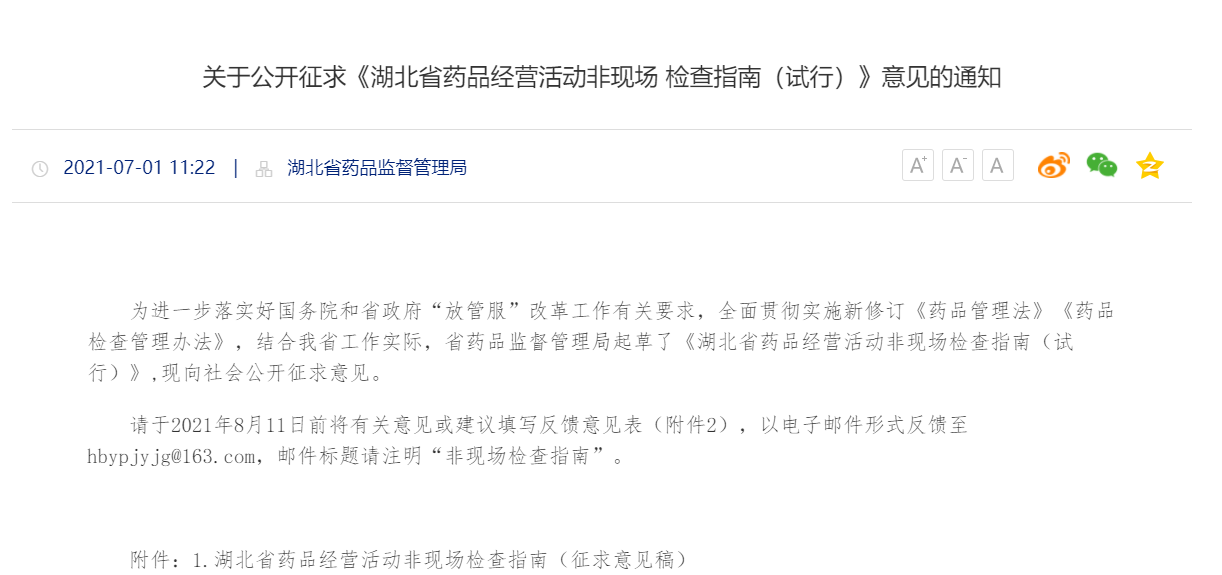
四、非现场检查如何实施?
五、企业如何应对非现场审计
目前做过非现场审计的药品经营企业较少,很多企业都不了解非现场审计怎么做,需要准备什么,担心药监部门的检查不通过,CIO合规保证组织小编为大家讲解某GSP远程审计的经典案例,让大家了解非现场审计。
2021年7月2日,CIO合规保证组织GMP合规专家白术、五加皮,GSP合规专家冬虫夏草三位专家联合,对MAH所委托的三家供应商进行远程审计,以视频会议、图文和文件交互等方式开展审计工作。

由上图可以看到,CIO合规保证组织专家在具备电子文件和信息交换平台的会议室里,通过实时视频对供应商现场进行审计。
药监部门的非现场检查和CIO合规保证组织的GSP远程审计模式一样,如果企业担心第一次做非现场检查没有经验,或者疫情原因没办法对自己和供应链上下游公司进行评估,又或者零售门店太多检查费用太高,可以找第三方专业机构进行GSP远程审计。提前做GSP远程审计,可以有效应对药监部门的非现场检查,减少应对检查的时间,提高企业的合规性。
自新冠疫情爆发以来,CIO合规保证组织一直积极探索远程审计和评估的措施和手段,经过前段时间的探索,这些工作逐步走上正轨,并积累了一定的经验。此次协助MAH对其所委托的供应商进行远程审计的顺利开展,将为我们后续其他远程项目的开展提供更加宝贵的经验。
相关文件下载、服务及学习课程:
合规文库:
合规服务:
远程服务:
 E邀专家
E邀专家




























