 E邀专家
E邀专家
医药投资新风向?四个角度深度解读2025年第3季度药品优先审评品种
CIO专家-山丹
2025年第三季度,CDE共将38项药品注册申请纳入优先审评程序,
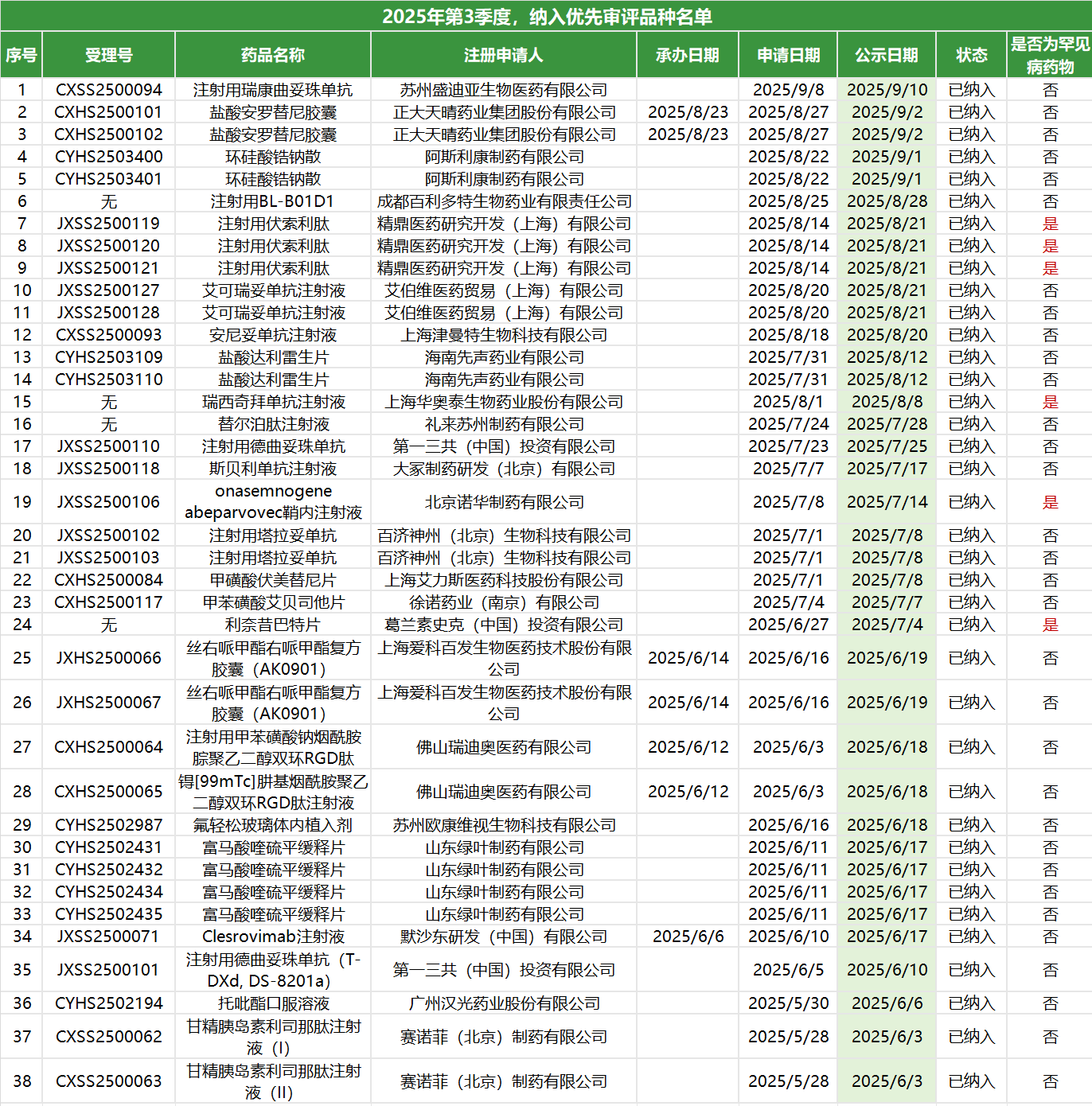
相较于一、二季度,第三季度优先审评呈现出更为鲜明的特点,
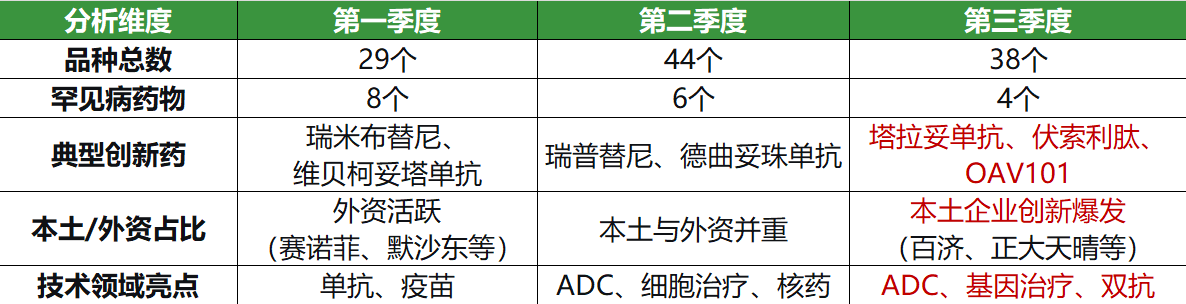
首先是前沿技术的突破:
1、基因治疗登台:
诺华的onasemnogene abeparvovec(OAV101)是一种用于治疗脊髓性肌萎缩症(SMA)的基因治疗药物。是目前全球用于治疗SMA的药物中唯一的基因疗法,标志着我国审评体系对最前沿治疗技术的接纳和推动。

2、双/多特异性抗体涌现:
同时,塔拉妥单抗(双特异性抗体)和艾可瑞妥单抗(三特异性抗体)的涌现都代表了肿瘤免疫治疗的下一代技术方向,结构更复杂,疗效目标也更精准。


这也预示着“硬核创新”才是获得优先审评的硬通货。
其次是本土创新力量的崛起:
相较于一、二季度外资巨头的亮眼表现,第三季度我国本土创新药企成为中流砥柱。
1、像百济神州、正大天晴等国内领军企业均有多款重要创新药入选。


2、“中美同步”也成为常态,比如科伦博泰的芦康沙妥珠单抗早在申报前就已达成海外授权合作。

说明我国本土药企的创新能力已得到官方认可和大力支持,国内企业应更有信心投入源头创新。
再者是CDE的审评效率仍在不断提升:
1、从时间线上可以观察到,第三季度从企业“申请”到CDE“公示”的时间间隔非常短,普遍在一周左右,部分品种甚至缩短至2-3个工作日。
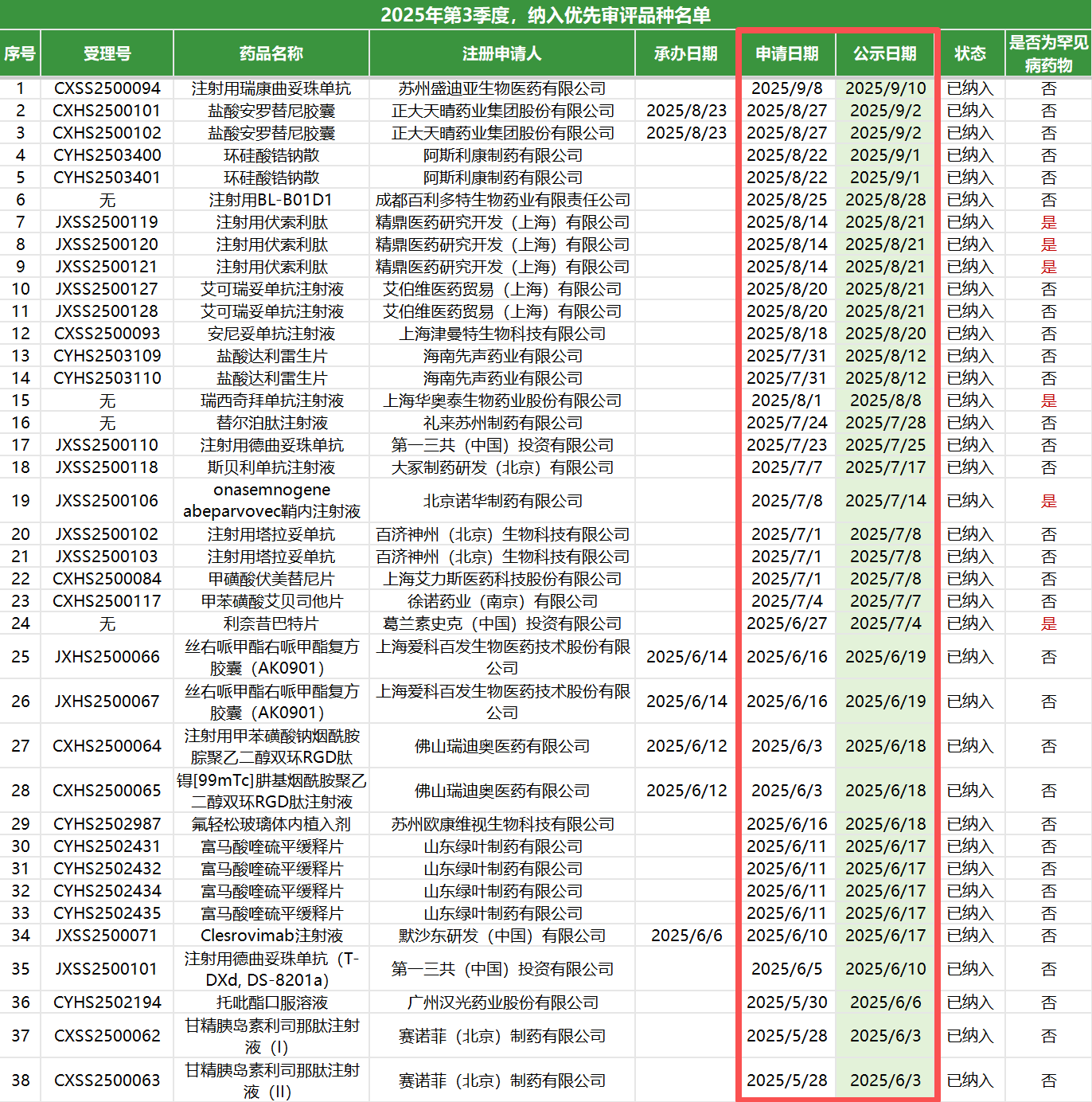
2、这体现了CDE在《药物研发与技术审评沟通交流管理办法》修订背景下,“早期介入、滚动审评、及时决策” 的能力日益增强,为企业节省了宝贵的上市时间。
企业在这个基础上,应优化内部注册流程,确保申报资料高质量一次性提交,并充分利用沟通交流机制,才能和监管机构的高效运作同频共振,最大化享受政策红利。
最后是优先审评的“临床价值” 导向始终未变:
比如治疗甲状旁腺功能减退的伏索利肽、治疗1型遗传性血管性水肿的利奈昔巴特片等,持续获得政策倾斜。


唯有真正解决未满足的临床需求,创新才是有意义的,也才能顺利获得监管支持。
总体而言,我国药品审评审批正在从 “追赶” 走向 “引领” ,从鼓励 “泛泛创新” 转向支持 “前沿、高质量、有全球竞争力” 的创新。对于医药企业,未来的战略选择愈发清晰:
1、敢于投入:在前沿技术领域进行长期、战略性的投入。
2、精耕细作:聚焦真正具有临床价值的差异化创新,而非低水平重复。
3、善用政策:主动适应并与高速、高效的监管体系协同,加速创新成果转化。
 E邀专家
E邀专家



























