基本信息
1、办理部门:湖南省药品监督管理局
2、办理方式:窗口申请,网上办理
3、办理地点:湖南省长沙市天心区银杏路6号政务服务大厅一楼B19-B26窗口
4、咨询电话:0731-82213672 CIO咨询:400-003-0818
受理条件
据《湖南省第二类创新医疗器械特别审查程序》湘药监发〔2019〕10号 第三条:申请人申请创新医疗器械特别审查,应当在产品首次注册申请前,填写《创新医疗器械特别审查申请表》,并提交申请资料。
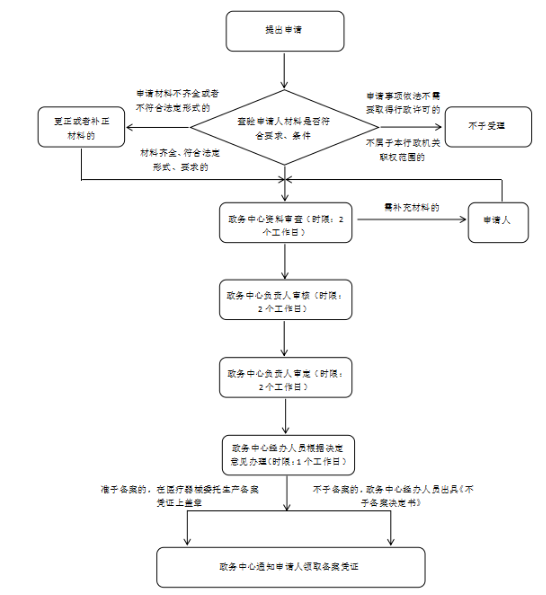
办理流程
流程文字说明
法定办结时限:20个工作日;承诺办结时限:7个工作日。
1、受理
2、办结:7个工作日
申请材料
1、《创新医疗器械特别审查申请表》;
2、资质证明文件;
3、证明文件;
4、产品研发过程及结果综述;
5、产品技术文件;
6、产品创新的证明性文件;
7、产品风险分析资料;
8、产品说明书(样稿);
9、保证声明。
常见问题
问题1:申请人申请创新医疗器械特别审查需要提交什么资料?
答:《湖南省第二类创新医疗器械特别审查程序》湘药监发〔2019〕10号 第三条:申请人申请创新医疗器械特别审查,应当在产品首次注册申请前,填写《创新医疗器械特别审查申请表》(见附1),并提交申请资料,资料应当包括:(一)申请人企业资质证明文件。(二)产品知识产权情况及证明文件。(三)产品研发过程及结果综述。(四)产品技术文件,至少应当包括: 1. 产品的适用范围或者预期用途; 2. 产品工作原理或者作用机理; 3. 产品主要技术指标及确定依据,主要原材料、关键元器件的指标要求,主要生产工艺过程及流程图,主要技术指标的检验方法。(五)产品创新的证明性文件,至少应当包括: 1. 核心刊物公开发表的能够充分说明产品临床应用价值的学术论文、专著及文件综述; 2. 国内外已上市同类产品应用情况的分析及对比(如有); 3. 产品的创新内容及在临床应用的显著价值。(六)产品风险分析资料。(七)产品说明书(样稿)。(八)其他证明产品符合本程序第二条的资料。(九)所提交资料真实性的自我保证声明。申报资料应当使用中文。原文为外文的,应当有中文译本。
本办事指南摘自药监局官网,如有变动,以官方发布为准。