基本信息
1、办理部门:上海市药品监督管理局
2、办理方式:窗口办理,网上办理
3、办理地点:上海市徐汇区虹梅路街道宜山路728号3号楼底楼大厅1-5号窗口
4、咨询电话: 021-63269368 CIO咨询:400-003-0818
受理条件
1、申请材料应完整、清晰;
2、网上申请信息应与证明材料一致;
3、企业名称、统一社会信用代码、住所、法定代表人、注册资本等应按照营业执照内容填写;
4、对照国家及本市药品监督管理部门政府外网的专栏信息进行审查,申请材料中的相关人员未被纳入国家药品安全“黑名单”或上海市药品监督管理局重点监管名单;
5、生产范围应按照国家药品监督管理部门颁布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
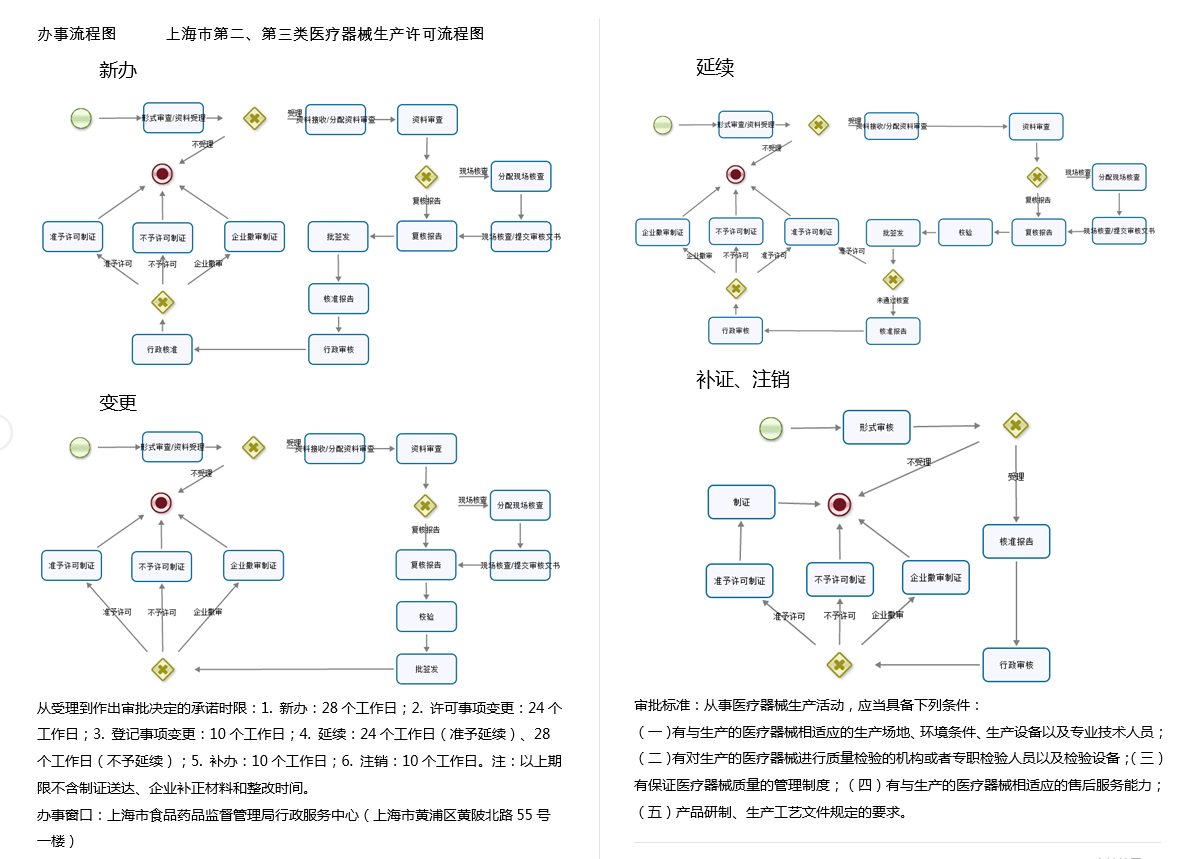
办理流程
流程文字说明
1、申请:申请人通过省政务服务网网上申报,并提交相关电子申请材料。申请人按照申报资料要求,提供一套纸质材料,通过邮寄或直接递交,或者委托相关人员递交省药品监督管理局受理大厅。
2、受理:5个工作日。
3、审查与决定:20个工作日。
从事医疗器械生产活动,应当具备下列条件:
(一)有与生产的医疗器械相适应的生产场地、环境条件、生产设备以及专业技术人员;
(二)有对生产的医疗器械进行质量检验的机构或者专职检验人员以及检验设备;
(三)有保证医疗器械质量的管理制度;
(四)有与生产的医疗器械相适应的售后服务能力;
(五)产品研制、生产工艺文件规定的要求。
4、颁证与送达:10个工作日。直接送达。
申请材料
1、医疗器械生产许可变更申请表;>>申请表
2、经办人员身份证;
3、企业主管部门的批文或董事会决议【法定代表人或企业负责人变更适用】;
4、门牌号码变更材料生产地址文字性变更材料【生产地址文字性变更适用】;
5、迁移后或新增生产地址的产权证和/或租赁协议(如申请人为房屋产权人,则仅需提交产权证)(迁移或增加生产地址适用) ;
6、迁移后或新增生产场地的平面图,并标明楼号、楼层和面积(迁移或增加生产地址适用);
7、环境监测报告(增加有洁净生产环境要求的产品,迁移或增加有洁净生产环境要求的生产地址适用);
8、医疗器械生产质量管理规范自查报告(迁移或增加生产地址、增加生产产品、减少生产地址适用);
9、减少前和减少后生产场地的平面图,并标明楼号、楼层和面积(减少生产地址适用);
10、拟增加医疗器械注册证(第三类医疗器械和外省市第二类医疗器械适用) ;
11、产品技术要求【增加生产范围】;
12、生产工艺流程图,注明主要控制项目和控制点以及是否外协生产,如关键工序和特殊过程的设备及工艺参数控制的说明(增加生产范围);
13、委托方营业执照【外省市医疗器械委托方适用】 ;
14、委托方《医疗器械生产许可证》和《医疗器械生产产品登记表》【外省市医疗器械委托生产方适用】 ;
15、YY0287/ISO13485认证证书【列入医疗器械注册人制度试点且受托生产第三类医疗器械的受托方适用】;
16、委托方创新医疗器械特别审批证明资料【增加受托生产范围且按照创新医疗器械特别审批程序审批的医疗器械注册人适用】;
17、委托方专职法规事务、质量管理、上市后事务人员的身份证(或护照)、学历(或者职称)证明以及专业背景和工作经验证明资料【增加受托生产范围】;
18、委托生产合同和质量协议(注:应明确双方委托生产中技术转移、质量保证、责任划分、放行要求等权利义务)【增加受托生产范围】;
19、委托方商业责任险合同【增加受托生产范围】;
20、委托生产医疗器械拟采用的说明书和标签样稿【增加受托生产产品适用】;
21、委托方对受托方质量管理体系的认可声明【增加受托生产范围】;
22、委托方关于委托生产医疗器械质量、销售及售后服务责任的自我保证声明【增加受托生产范围】。
结果样本

常见问题
问题1:《医疗器械生产许可证》的形式是什么?
答:医疗器械生产许可证分为正本和副本,有效期为5年。正本和副本载明许可证编号、企业名称、统一社会信用代码、法定代表人(企业负责人)、住所、生产地址、生产范围、发证部门、发证日期和有效期限。副本记载许可证正本载明事项变更以及车间或者生产线重大改造等情况。企业名称、统一社会信用代码、法定代表人(企业负责人)、住所等项目应当与营业执照中载明的相关内容一致。
问题2:从事医疗器械生产活动应当具备什么条件?
答:从事医疗器械生产活动,应当具备下列条件:(一)有与生产的医疗器械相适应的生产场地、环境条件、生产设备以及专业技术人员;(二)有能对生产的医疗器械进行质量检验的机构或者专职检验人员以及检验设备;(三)有保证医疗器械质量的管理制度;(四)有与生产的医疗器械相适应的售后服务能力;(五)符合产品研制、生产工艺文件规定的要求。
本办事指南摘自药监局官网,如有变动,以官方发布为准。