河南省药品抽检年报(2024年)
河南省
2024年是实施“十四五”规划的关键之年。河南省药品监督管理局在省委、省政府的坚强领导下,在国家药监局的正确指导下,认真贯彻落实《国家药监局关于进一步做好地方药品抽检工作的通知》(国药监药管函〔2023〕18号)要求,坚持问题导向和风险防控的原则,紧紧围绕药品监管需求,聚焦监管重大战略、重点品种、重点环节,科学组织实施药品抽检工作;组织各地市市场监督管理局、省药监局各监管分局、省药品医疗器械检验院等药品监管部门与相关检验机构,在全省范围内对生产、经营、使用等环节的药品开展抽查检验工作,评估上市后药品的质量状况,打击制售假劣药品行为。2024年河南省药品抽检结果显示,当前我省药品安全形势总体平稳可控,药品质量持续保持在较高水平。
一、概述
药品抽检是药品监管的重要手段,是提高药品质量安全水平,实现风险管理、科学管理的重要技术支撑。
2024年,河南省药品抽检共完成1687个品种10171批次的抽检任务,抽检合格药品10154批次,抽检合格率为99.83%。样品来源涉及159家药品生产企业或配制单位、1505家经营企业和685家使用单位。对检出的17批次不符合规定产品,河南省药监局组织各抽检单位及时采取相应的风险控制措施,通过科
学分析研判,确定风险点,对涉事企业和单位依法进行查处。通过对不符合规定产品查控和信息公开、对风险线索核查处置,对药品从业主体形成了强烈震慑,强化了药品全生命周期和全过程质量控制的意识。
二、抽检数据分析
(一)抽样情况
2024年河南省药品抽检共抽取药品1687个品种,其中基本药物品种513个,专项抽检品种412个,日常监督抽检品种1321个。共抽检样品10171批次,包括生产环节2149批次、使用环节2641批次、流通环节5381批次(见图1),涉及159家药品生产企业、1505家经营企业和685家使用单位。抽检样品剂型覆盖片剂、颗粒剂、注射剂、胶囊剂、丸剂、合剂、散剂、贴膏剂、糖浆剂、乳膏剂、软膏剂、口服混悬剂、口服溶液剂、酊剂、眼用制剂、溶液剂、滴剂、膏药、栓剂、凝胶剂、胶剂、搽剂、锭剂、耳用制剂、露剂、流浸膏剂、喷雾剂、洗剂等28种药品剂型,包括化学药品4000批次、抗生素药品761批次、生化药品156批次、中成药3397批次、中药材及饮片1698批次、其他类药品159批次(原料药、药包材、药用辅料、医院制剂等)。各单位抽取样品的标示生产企业所在地区分布情况见图2。
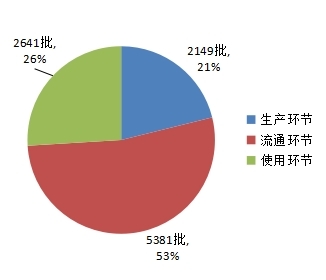
图1.2024年河南省药品抽检各抽样环节抽样情况
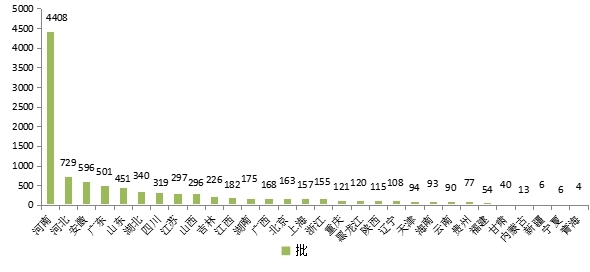
图2.2024年河南省药品抽检样品产地分布图
(二)药品抽检结果分析
2024年河南省药品抽检共抽检药品10171批次。经检验,10154批次药品符合规定,17批次药品不符合规定。
1.基本药物抽检
2024年国家基本药物抽检完成2273批次(化学药1378批次,抗生素161批次,生化药3批次,中成药484批次,中药饮片247批次),涉及生产环节1334批次、经营环节796批次、使用环节143批次。经检验,符合规定2272批次,不符合规定1批次,在生产、经营、使用环节检出不符合规定样品依次为1、0、0批次。问题产品的不符合规定项目为检查项。
抽检结果显示:国家基本药物整体质量状况较好。
2.专项抽检
2024年专项抽检任务完成2708批次(化学药1091批次,抗生素87批次,生化药55批次,中成药400批次,中药材及饮片951批次,原料药40批次、药用辅料50批次,药用包材20批次,医院制剂14批次),涉及生产环节620批次、经营环节1310批次、使用环节778批次。经检验,符合规定2702批次,不符合规定6批次,在生产、经营、使用环节检出不符合规定样品依次为0、2、4批次。
不符合规定项目包括性状(2批次)、检查(4批次)和含量测定(1批次),分别占全部不符合规定项目的28.6%、57.1%和14.3%。
3.日常监督抽检
2024年日常监督抽检任务完成5190批次(化学药1898批次,抗生素242批次,生化药13批次,中成药2517批次,中药材及饮片498批次,医院制剂22批次),涉及生产环节167批次、经营环节3278批次、使用环节1745批次。经检验,符合规定5180批次,不符合规定10批次,在生产、经营、使用检出不符合规定样品0、3、7批次。
不符合规定项目主要涉及性状、鉴别、检查和含量测定,不符合规定产品数量依次为5、1、4和1批次,分别占全部不符合规定项目的45.5%、9.1%、36.4%和9.1%。
4.国家药品集中采购中选品种及通过仿制药一致性评价品种抽检
2024年国家药品集中采购中选品种及通过仿制药一致性评价品种抽检68个品种450批次,在生产、经营、使用环节各抽取样品204批次、231批次、15批次。经检验,所检项目均符合规定,合格率为100%。
5.境外生产药品抽检
2024年境外生产药品抽检20个品种35批次,涉及5个剂型,其中经营环节30批次、使用环节5批次。经检验,所检项目均符合规定,合格率为100%。
6.中药材及饮片专项抽检
2024年中药材及饮片专项抽检14个品种675批次,经检验,符合规定670批次,不符合规定5批次。
不符合规定项目主要涉及性状(2批次)、检查(3批次)、含量测定(1批次)等,分别占全部不符合规定项目的33.3%、50.0%、16.7%。
抽检结果显示:我省中药材及中药饮片总体质量状况良好。但不规范种植、采收季节不适宜、净制不当、加工炮制不规范、贮存与养护措施不当等现象依然存在。
7.中药材质量监测
2024年,河南省药监局组织对部分药品生产企业、中药材交易市场、药材经营企业、中药材种植基地的中药材质量进行监测,全年共监测3个品种159批次样品。其中,药品生产企业32批次、中药材交易市场39批次、药材经营企业74批次、中药材种植基地14批次。根据样品的品种特点,对有关项目进行了研究性检验。监测发现的主要问题有外源性有害物质超限、盲目异地引种、种植采收及产地加工不规范、储存不当等。
8.探索性研究
对于小儿氨酚黄那敏颗粒、小儿复方鸡内金散等儿童用药,藿香正气合剂、盐酸二氧丙嗪片等呼吸系统药物开展有针对性的探索性研究,全面考察药品质量的稳定性、现行标准的可行性,同时探寻可能存在的潜在风险,为提升药品质量标准、提高监管水平提供科学可靠的技术支撑。
探索性研究结果表明:①个别品种现行标准缺少专属性检验项目或者专属性检验项目较少,不能有效控制其质量,需提高质量标准;②某些制剂品种处方原料药有掺伪掺假的可能,需研究建立药物制剂中易掺伪掺假成分的检测方法;③个别品种现行标准的检测方法准确度不高或者检测条件重现性差,需改进其检测方法或者优化其检测条件;④某些企业品种现行标准的检验项目设置过于单一,且未能及时修订其质量标准,缺乏对产品质量和安全风险的有效防范与控制。企业可结合实际情况,逐步修订这些品种的质量标准。
三、抽检结果应用
药品抽检作为药品上市后监管的重要手段,在发现药品质量风险、打击违法违规行为中发挥着不可替代的重要作用,是实现科学监管、严格监管的重要技术支撑。河南省药品抽检的目的不仅仅是把控风险、规范生产和保障药品质量安全,其成果的积极运用更是持续提升药品质量,推动产业提质升级的重要途径。
(一)聚焦社会热点,主动开展专项风险监测
聚焦社会热点、潜在风险点、药品监管的难点堵点等,河南省药品抽检设置了中药材及中药饮片专项、儿童用药专项、呼吸系统用药专项、胰岛素专项、集采中选品种及通过仿制药一致性评价品种专项等,为科学监管提供技术支撑。针对可能存在的风险点,还专门设置有关物质专项、注射剂专项、药品委托生产专项等,识别挖掘潜在风险。2024年,首次开展了省级中药材质量监测,持续增强中药材质量监测力度,进一步提升抽检服务监管的效能。
(二)完善制度体系,积极探索药品网络抽检模式
在互联网蓬勃发展的时代,药品网络销售日益成为一种常见的药品购销途径,为人民群众带来许多便捷,但也伴随着诸多风险与挑战。为加强网络销售药品质量安全的监督管理,规范网络销售药品抽样检验工作,河南省药监局在2024年制定印发了《河南省药品网络抽检工作暂行办法》。此办法细化药品网络抽检的工作要求和标准,规范网络抽样检验行为,还对药品网络抽样结算模式、药品网络抽样的财务报销制度、网络抽样人员的备案方式、处方药的抽取方法等做了详尽的规定。此办法探索研究了药品网络抽检新模式,助力药品网络监管,着力消除药品网络销售的安全隐患,切实保障公众用药安全。
(三)严格防控风险,全力确保药品质量安全
2024年,河南省药监局对国家药品抽检发现的涉及本行政区域内的不符合规定产品,第一时间采取了查封扣押、暂停销售使用、要求企业主动召回等风险控制措施;对涉及的相关企业和单位均依法组织查处;同时要求药品生产企业认真排查,督促其查找问题原因并切实整改,确保质量安全隐患得到及时有效清除。通过药品抽检严厉打击了制售假劣药品的行为,发挥了震慑不法企业、净化市场环境的作用。
(四)及时信息公开,积极回应社会关切
2024年,河南省药监局继续以通告的形式,依法及时向公众发布不符合规定药品抽检信息,警示安全用药、震慑不法企业,切实筑牢公众用药安全防线。
四、结语
2024年河南省药品抽检工作圆满完成。抽检及探索性研究结果显示,我省药品质量仍处于较高水平,整体安全形势稳中向好。
2025年是“十四五”规划的收官之年。河南省药监局将认真落实习近平总书记关于药品监管工作的重要指示批示精神,将“四个最严”要求贯穿到监管实践中,逐步健全完善药品抽检模式,坚决筑牢药品安全底线,努力实现高水平安全和高质量发展,更好地保障人民群众用药安全。
2025年6月4日
相关推荐:
最新推荐

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

医疗机构制剂注册备案
1.CIO为医疗机构配制制剂提供一站式合规服务。 2.帮助医疗机构取得医疗机构制剂注册批件。 3.价格合理,服务更省心。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

医疗器械互联网信息服务备案
自2025年1月20日起,国家药监局将“药品、医疗器械互联网信息服务审批”改为备案管理。我们为自建网站或平台销售医疗器械的企业提供专业的医疗器械互联网信息服务备案咨询服务,帮助企业高效完成备案。

药品互联网信息服务备案
自2025年1月20日起,药品和医疗器械互联网信息服务审批不再需要前置审批,转而实行备案管理。我们致力于为药企提供高效、专业的药品互联网信息服务备案服务,帮助客户顺利开展网络销售业务。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。






