关于公开征求《皮肤刺激性/腐蚀性试验技术指导原则(征求意见稿)》等意见的通知
全国

各有关单位:
为进一步规范和指导化妆品及新原料的安全评价工作,根据《化妆品监督管理条例》《化妆品注册备案管理办法》等相关法规和配套文件要求,中检院起草了《皮肤刺激性/腐蚀性试验技术指导原则(征求意见稿)》等7项技术指导原则及其起草说明(附件1-14),现公开向社会征求意见。反馈意见请填写意见反馈表(附件15),于2023年5月20日前发送电子邮件至hzppjzx@nifdc.org.cn。
附件:
1.《皮肤刺激性/腐蚀性试验技术指导原则(征求意见稿)》
2.《皮肤刺激性/腐蚀性试验技术指导原则(征求意见稿)》起草说明
3.《急性眼刺激性/腐蚀性试验技术指导原则(征求意见稿)》
4.《急性眼刺激性/腐蚀性试验技术指导原则(征求意见稿)》起草说明
5.《皮肤光毒性试验技术指导原则(征求意见稿)》
6.《皮肤光毒性试验技术指导原则(征求意见稿)》起草说明
7.《细菌回复突变试验技术指导原则(征求意见稿)》
8.《细菌回复突变试验技术指导原则(征求意见稿)》起草说明
9.《人体皮肤斑贴试验技术指导原则(征求意见稿)》
10.《人体皮肤斑贴试验技术指导原则(征求意见稿)》起草说明
11.《人体安全性试用试验技术指导原则(征求意见稿)》
12.《人体安全性试用试验技术指导原则(征求意见稿)》起草说明
13.《防晒化妆品长波紫外线防护指数(PFA值)检测技术指导原则(征求意见稿)》
14.《防晒化妆品长波紫外线防护指数(PFA值)检测技术指导原则(征求意见稿)》起草说明
15. 意见反馈表
中检院
2023年4月27日
皮肤刺激性/腐蚀性试验技术指导原则(征求意见稿)
一、概述
皮肤刺激性/腐蚀性试验是确定和评价受试物对哺乳动物皮肤局部是否有刺激作用或腐蚀作用及其程度的试验。
本指导原则依据《化妆品安全技术规范》《化妆品注册和备案检验工作规范》《化妆品注册备案资料管理规定》《化妆品新原料注册备案资料管理规定》等相关要求,并参考国内外相关指南制定。
本指导原则适用于化妆品和新原料的皮肤刺激性/腐蚀性及其程度的评价及安全评估。
本指导原则是在现行法规和标准以及当前科学认知水平下制定的,随着法规和标准的更新完善,以及科学技术的发展,将适时进行调整。
二、基本原则
本指导原则仅阐述皮肤刺激性/腐蚀性试验需要重点关注的问题,试验时需具体情况具体分析。
皮肤刺激性/腐蚀性试验的设计应符合毒理学试验随机、对照、重复的基本原则,试验数据应真实、完整、准确、可追溯,试验结果统计分析应科学合理。
如果实验动物在试验的任何阶段出现严重抑郁、痛苦的表现,应当给予人道处死。
三、基本内容
将受试物一次(或多次)涂敷于受试动物的皮肤上,在规定的时间间隔内,观察动物皮肤局部刺激作用的程度并进行评分。
(一)实验动物饲养管理和使用
实验动物应为健康、成年、皮肤无损伤的哺乳动物,首选白色家兔。雌雄均可,雌性动物应为未孕及未曾产仔的。
试验一般至少需要4只动物,如需进一步解释可疑实验结果,可增加动物数。
实验动物、饲养设施及动物实验室应符合国家相应规定。动物应单笼饲养,试验前进行检疫并使动物适应环境。给予实验动物常规饲料喂养,自由饮水,室内光照条件应保持12小时明暗交替。
(二)受试物
若受试物为液体,一般不做稀释,直接使用原液。若受试物为固体,应制备为细粉状,并用水或其它无刺激性溶剂将其充分湿润,以保证受试物与皮肤有良好的接触;若使用其他溶剂润湿受试物,应考虑溶剂是否会对受试物的皮肤刺激性产生影响。若产品的使用方法是需要稀释后使用,应先进行产品原型的皮肤刺激性/腐蚀性试验,如果试验结果显示皮肤刺激性结果为中度以上,可选用合适的溶剂按使用浓度进一步稀释后,检测其皮肤刺激性/腐蚀性试验,并设置溶剂对照。
试验时应按照产品实际使用方法配制受试物,并明确配制方法和使用浓度。
若预判受试物可能引起严重刺激或腐蚀作用,可先进行预实验,一般采取分段试验法,考察受试物是否会在3分钟、60分钟和4小时中任何一个时间点,出现皮肤腐蚀作用。当皮肤涂敷受试物的部位,在以上任何一个时间点出现严重皮肤刺激或腐蚀作用,不再进行后续试验。
此外,以下情况可不进行皮肤刺激试验:
1. 受试物为强酸或强碱(pH值≤2或≥11.5);
2. 受试物有很强的经皮吸收毒性,经皮LD50<200 mg/kg;
3. 受试物在急性经皮毒性试验中,剂量达2000 mg/kg时仍未出现皮肤刺激性作用。
对于化妆品新原料,应根据原料的溶解性选择适宜的溶剂进行润湿或稀释配制,并设阴性对照。
(三)各组别的给予方式和剂量
备皮:试验前约24小时将动物背部脊柱左右两侧毛剪掉约3 cm×3 cm范围,不可损伤表皮。
受试物区:一般取受试物样品0.5 mL(g)均匀涂布于受试部位,涂抹面积为2.5 cm×2.5 cm。若受试物样本难以获得,用量可适当减少。
对照区:试验采用自身对照,以科学评判受试物对皮肤的刺激作用。当受试物使用无刺激性溶剂配制时,于涂抹受试物的皮肤另一侧涂抹溶剂作为对照。
为保证试验的一致性,涂布面积应尽量相等。
给予方式:采用封闭试验,敷用时间一般为4小时,一次/每次敷用结束后用温水或无刺激性溶剂清除残留受试物。对于化妆品产品,可根据人体实际使用情况和产品类型延长或缩短敷用时间。用后冲洗的化妆品产品,可仅敷用2小时。
急性皮肤刺激性试验仅给予受试物1次;多次皮肤刺激性试验为每天涂抹1次,连续涂抹14天。
四、结果分析与评价
(一)结果观察与分析
1. 急性皮肤刺激性试验:清除受试物后1、24、48和72小时观察涂抹部位皮肤反应,72小时仍未观察到刺激反应或刺激反应完全恢复,即可停止观察。在皮肤涂敷部位出现刺激反应且未恢复之前,应每天继续观察,观察时间应延长至足以观察到可逆或不可逆刺激作用的全过程,一般不超过14天。按《化妆品安全技术规范》中的标准对受试物区和对照区进行皮肤评分并记录,皮肤反应主要分为红斑和焦痂形成,以及水肿形成两种表现。当皮肤涂敷部位出现严重红斑(紫红色)至轻微焦痂形成或重度水肿(皮肤隆起超过1 mm,范围扩大)时,均分别记4分;当出现中度至重度红斑或中度水肿(皮肤隆起约1 mm)时,均分别记3分;当出现明显红斑或轻度水肿(皮肤隆起轮廓清楚)时,均分别记2分;当轻微红斑或水肿(勉强可见)时,均分别记1分;最终以受试动物积分的平均值进行综合评价。
根据24、48和72小时三个观察时间点之中最高积分均值,按《化妆品安全技术规范》中的标准判定皮肤刺激强度,积分均值为6.0~8.0时,结果为强刺激性;积分均值为2.0~<6.0时,结果为中刺激性;积分均值为0.5~<2.0时,结果为轻刺激性;积分均值为0~<0.5时,结果为无刺激性。
2. 多次皮肤刺激性试验:清除受试物后1小时观察局部皮肤反应,按《化妆品安全技术规范》中的标准进行评分并记录,皮肤刺激反应的评分标准同“急性皮肤刺激性试验”。按照下列公式计算每天每只动物平均积分,按《化妆品安全技术规范》中的标准判定刺激强度,皮肤刺激强度的分级标准同“急性皮肤刺激性试验”。
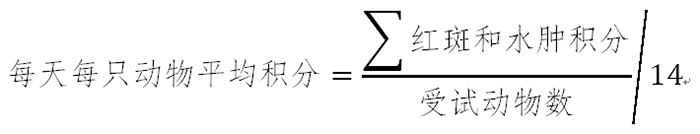
3. 需注意的是,两项试验中,观察时间点为1小时的积分不计算在内。
(二)结果解释
1. 急性皮肤刺激性试验结果从动物外推到人的可靠性有限;
2. 白色家兔在大多数情况下对有刺激性或腐蚀性的物质较人类敏感。若用其它品系动物进行试验时也得到类似结果,则会增加从动物外推到人的可能性。
3. 当试验出现非预期结果或可疑结果时,则需追加动物进行重复试验。
(三)结果评价
化妆品产品的急性皮肤刺激性试验和多次皮肤刺激性试验结果一般不得有明显的刺激性和腐蚀性,即皮肤刺激强度为轻刺激性及以下(积分均值<2.0)。
婴幼儿和儿童用产品从严要求,其皮肤刺激性试验结果应为无刺激性(积分均值<0.5)。
五、参考文献
1. 国家药品监督管理局.化妆品安全技术规范.(2015.12)
2. OECD. OECD Guideline for the testing of chemicals: Acute dermal irritation/corrosion (404).(2015.7)
3. 中华人民共和国卫生部. 中华人民共和国国家职业卫生标准 化学品毒理学评价程序和试验方法 第6部分:急性 皮肤刺激性/腐蚀性试验: GBZ/T 240.6-2011. (2011.8)
六、术语和释义
(一)皮肤刺激性(Dermal irritation):
皮肤涂敷受试物后局部产生的可逆性炎性变化。
(二)皮肤腐蚀性(Dermal corrosion):
皮肤涂敷受试物后局部引起的不可逆性组织损伤
七、附录
可参考《化妆品安全技术规范》中收录的“皮肤刺激性/腐蚀性试验”方法。
《皮肤刺激性/腐蚀性试验技术指导原则(征求意见稿)》起草说明
为规范开展化妆品和新原料的安全评估工作,根据《化妆品监督管理条例》《化妆品注册备案管理办法》《化妆品注册备案资料管理规定》《化妆品新原料注册备案资料管理规定》及相关法律法规、强制性国家标准和技术规范的要求,国家药监局化妆品监管司组织中国食品药品检定研究院(以下简称中检院)组织起草了《皮肤刺激性/腐蚀性试验技术指导原则(征求意见稿)》(以下简称《技术指导原则(征求意见稿)》)。现将起草的有关情况说明如下:
一、起草的必要性
2021年5月1日,《化妆品监督管理条例》和相关配套法规已正式施行。我国《化妆品安全技术规范》 (2015版) 中“毒理学试验方法”规定:化妆品新原料需进行皮肤和急性眼刺激性/腐蚀性试验,同时化妆品产品在投放市场前,对于每天使用的化妆品需进行多次皮肤刺激性试验,进行多次皮肤刺激性试验者不再进行急性皮肤刺激性试验;对于间隔1日或数日使用或使用后冲洗的化妆品需进行急性皮肤刺激性试验。《化妆品注册和备案检验工作规范》《化妆品注册备案资料管理规定》中规定,发用类和芳香类化妆品需要进行急性皮肤刺激性试验;护肤类和彩妆类化妆品需要进行多次皮肤刺激性试验。此外,该试验可对新原料是否具有皮肤刺激性进行检测或安全评估。因此,中检院组织制定《技术指导原则》(征求意见稿),以规范应用皮肤刺激性/腐蚀性试验评价化妆品和新原料的皮肤刺激性。
二、制定原则
(一)依法依规原则。《技术指导原则(征求意见稿)》遵循依法依规原则,贯彻落实《化妆品监督管理条例》及配套法规文件中关于化妆品和新原料的法规要求,研究皮肤刺激性/腐蚀性试验的具体要求,切实为化妆品和新原料的安全评估提供技术指导,也为技术审评以及监管提供依据。
(二)公开透明原则。《技术指导原则(征求意见稿)》起草过程中,坚持“公开透明、广泛参与”原则,充分参考国内外相关法规和技术标准,积极征求监管部门、专家、行业协会意见,同时根据意见反馈情况科学合理地进行修改完善。
三、主要内容
《技术指导原则(征求意见稿)》主要内容包括制定背景和法规依据、适用范围和基本原则;实验动物饲养管理和使用、受试物的配制、受试物组和对照组给予方式和剂量的设计、需要增加动物或追加试验的情况、实验结果观察与分析;结果分析与评价等。
急性眼刺激性/腐蚀性试验技术指导原则(征求意见稿)
一、概述
急性眼刺激性/腐蚀性试验是检测物质对试验动物眼和粘膜的原发性刺激和腐蚀作用的急性试验,确定和评价化妆品原料及其产品对哺乳动物的眼睛是否有刺激作用或腐蚀作用及其程度,为人类眼和粘膜接触该受试物的潜在危害提供资料。
本指导原则依据《化妆品安全技术规范》《化妆品注册和备案检验工作规范》《化妆品注册备案资料管理规定》《化妆品新原料注册备案资料管理规定》等法规技术资料相关要求,并参考国内外相关指南制定。
本指导原则适用于化妆品和新原料的急性眼刺激性/腐蚀性检测、评价研究及其安全性评估,重点阐述化妆品和新原料在急性眼刺激性/腐蚀性试验中的试验方法、对所获得数据的分析和评价要求,以及需要重点关注的问题,试验时需具体情况具体分析。
本指导原则是在现行法规和标准以及当前科学认知水平下制定的,随着法规和标准的更新完善,以及科学技术的发展,将适时进行调整。
二、基本原则
(一)试验设计原则
急性眼刺激性/腐蚀性试验的设计应符合毒理学试验随机、对照、重复的基本原则,试验数据应真实、完整、准确、可追溯,试验结果应科学合理。
(二)检验管理
检验机构出具的检验报告应符合《化妆品注册和备案检验工作规范》、《化妆品安全技术规范》及相关法规要求,包括检验机构资质、检验机构选择、检验方法、检验程序、结果分析、报告体例等。
三、基本内容
在开展化妆品和新原料的检测时,需重点关注以下内容。
(一)受试物
受试物一般可先选择预试验进行判断,若预试验结果显示,受试物可能引起严重刺激或腐蚀作用,出现以下情况,可不再进行眼刺激性试验:
1、受试物为强酸或强碱(pH值≤2或≥11.5);
2、受试物已被证实对皮肤有腐蚀性或强刺激性;
若受试物为固体或颗粒状,在染毒前应将其粉碎、研磨成细粉状。若受试物为液体,对于化妆品新原料,一般可采用预试验选择受试物的浓度;对于化妆品产品,一般不需稀释,可直接使用原液染毒。
对于喷雾或气雾产品,需将受试物喷至容器中,收集液体再进行试验。
(二)试验动物
试验动物一般首选健康成年、眼睛无损伤的白色家兔,至少使用3只,试验动物和试验动物房应符合国家相关规定。
试验前,动物要在试验动物房环境中至少适应3天时间。试验开始前24h内,要借助于辅助光源对每只试验动物的两只眼睛进行检查,还包括使用荧光素钠检查。如果试验动物有眼睛刺激症状、角膜缺陷和结膜损伤,则不能用于试验。
(三)试验方法
一般受试物样品染毒量为0.1ml或100mg,需滴入(或涂入)结膜囊中,使上、下眼睑被动闭合1s,防止受试物丢失,染毒量应作详细记录。不做处理的另一侧眼睛作为自身对照。滴入受试物后24h内不冲洗眼睛。若认为必要,在24h时可进行冲洗。当试验出现非预期结果或可疑结果时,则需追加动物进行重复试验。
如果实验结果显示受试物有刺激性,则需考虑另选3只动物进行冲洗眼睛的效果试验,即给家兔眼滴入受试物后 4s及30s用足量、流速较快但又不会引起动物眼损伤的水流冲洗至少 30s。另一侧作为对照的眼睛也需采用同样的处理方式。
如果预先知晓受试物对眼睛可能会产生刺激或腐蚀作用,可以考虑先用一只动物进行预试验,如果试验结果显示有明显的刺激或腐蚀作用,则无需再选用更多的动物进行试验。
试验动物在试验的任何阶段出现严重抑郁、痛苦的表现,需给予人道处死,依据试验情况对受试物进行适当评价;如果出现角膜穿孔、角膜溃疡、角膜4分超过48h、缺乏光反射超过72h、结膜溃疡、坏疽、腐烂等情况,通常为不可逆损伤的症状,也应该给予人道地处死。
对于一般产品,应根据产品具体使用方法选择冲洗或不冲洗试验;对于使用后需要冲洗的产品(如洗面奶、发用品、防脱发冲洗类),一般仅做30s冲洗试验;对于染发类产品,一般只做4s冲洗试验;对于使用后不冲洗的产品(如眼部彩妆品、眼霜),一般做不冲洗试验。
四、结果分析与评价
(一)试验观察与记录分析
在滴入受试物后于第1h、24h、48h、72h以及第4d和第7d依据《化妆品安全技术规范》中的眼睛损害的评分标准对动物眼睛进行检查并记录。根据以给受试物后动物角膜、虹膜和结膜各自在24、48或72h观察时点的刺激反应的最高积分均值和恢复时间评价,按《化妆品安全技术规范》中的化妆品或原料眼刺激反应分级判定受试物对眼睛的刺激强度。
如果染毒后72h仍未观察到染毒眼出现刺激反应,则可结束试验。如果发现累及角膜或有其他眼刺激作用,7d内不恢复者,为确定该损害的可逆性或不可逆性需延长观察时间,一般不超过21d,并提供7d、14d 和21d的观察报告。除此以外,在试验进行的各阶段应对试验动物进行全面观察,包括全身反应和局部反应,并作完整记录。在进行眼睛检查时,可借助于适用的仪器设备进行眼刺激反应检查,在每次检查中均应按眼睛损害的评分标准记录眼刺激反应的积分。
(二)结果分析评价
根据染毒后受试动物眼睛在不同时间点观察到的刺激反应的最高积分均值和恢复时间评价,按《化妆品安全技术规范》中的化妆品或原料眼刺激反应分级判定受试物对眼的刺激或腐蚀作用的有无及强度。除此以外,有时还应结合观察到的眼睛其他损伤、病理组织学改变、可恢复性等对受试物的眼睛刺激性或腐蚀性进行综合评价。
需要注意的是,一般观察时间点为1h的积分不计入评分结果;当角膜、虹膜、结膜积分为0时,可判定为无刺激性。
(三)结果解释
急性眼刺激性试验结果从动物外推到人的可靠性很有限。受试动物的种属、品系、级别、数量、体重、来源,受试前眼睛的状态,实验条件、实验动物的饲养环境等因素,都可影响结果的准确性和可信度。白色家兔在大多数情况下对有刺激性或腐蚀性的物质较人类敏感。若用其他品系动物进行试验时也得到类似结果,则会增加从动物外推到人的可靠性。
五、参考文献
[1] 国家药品监督管理局.化妆品安全技术规范.2015.
[2] OECD. OECD Guideline for the testing of chemicals: Acute Eye Irritation/Corrosion Test (405).
[3] 中华人民共和国国家标准:化学品 急性眼刺激性/腐蚀性试验: GB/T 21609-2008.
六、附录
试验方法可参照《化妆品安全技术规范》中收录的“急性眼刺激性/腐蚀性试验”。
《急性眼刺激性/腐蚀性试验技术指导原则》(征求意见稿)起草说明
为规范开展化妆品和新原料的安全评价工作,根据《化妆品监督管理条例》《化妆品注册备案管理办法》《化妆品注册备案资料管理规定》《化妆品新原料注册备案资料管理规定》及相关法律法规、强制性国家标准和技术规范的要求,中国食品药品检定研究院(以下简称中检院)组织起草了《急性眼刺激性/腐蚀性试验技术指导原则》(征求意见稿)(以下简称《技术指导原则(征求意见稿)》)。现将起草的有关情况说明如下:
一、起草的必要性
2021年5月1日,《化妆品监督管理条例》和相关配套法规已正式施行。《化妆品注册备案资料管理规定》《化妆品注册和备案检验工作规范》规定“急性眼刺激性/腐蚀性试验”为染发类、烫发类、防脱发类特殊化妆品的一项注册检验项目。另外,化妆品安全评估报告中,关于化妆品原料急性眼刺激性/腐蚀性的评估也通常采用该项试验的数据作为原料评估的证据。在对该项试验的检验报告资料进行审评时,发现存在产品眼刺激性反应分级试验结果评判错误,或试验结果计算错误等情况频现。因此,中检院制定《技术指导原则》(征求意见稿),以规范应用急性眼刺激性/腐蚀性试验评价化妆品和新原料。
二、制定原则
(一)依法依规原则。《技术指导原则(征求意见稿)》遵循依法依规原则,贯彻落实《化妆品监督管理条例》及配套法规文件中关于化妆品和新原料的法规要求,研究急性眼刺激性/腐蚀性试验的具体要求,切实为化妆品和新原料的安全评价提供技术指导,也为技术审评以及监管提供依据。
(二)公开透明原则。《技术指导原则(征求意见稿)》起草过程中,坚持“公开透明、广泛参与”原则,充分参考国内外相关法规和技术标准,积极征求监管部门、专家、行业协会意见,同时根据意见反馈情况科学合理地进行修改完善。
三、主要内容
《技术指导原则(征求意见稿)》主要内容包括制定背景和法规依据、适用范围和基本原则、受试物的准备、试验动物的选择、试验方法的操作、试验观察与记录分析、试验结果与评价等。
皮肤光毒性试验技术指导原则(征求意见稿)
一、概述
光毒性(phototoxicity)指皮肤一次接触化学物质后,继而暴露于紫外线照射下所引发的一种皮肤毒性反应,或者全身应用化学物质后,暴露于紫外线照射下发生的类似反应。将受试物涂抹于动物背部去毛的皮肤上,观察经一定时间间隔后暴露于长波紫外线光线(UVA)下的皮肤反应,可考察该受试物是否具有光毒性。
本指导原则依据《化妆品安全技术规范》《化妆品注册备案资料管理规定》《化妆品新原料注册备案资料管理规定》《化妆品注册和备案检验工作规范》等要求制定。
本指导原则适用于化妆品和新原料的光毒性研究及安全评估。
本指导原则是在现行法规和标准以及当前科学认知水平下制定的,随着科学研究的进展,本指导原则中的相关内容将不断完善与更新。
二、基本原则
光毒性试验设计应符合毒理学试验随机、对照、重复的基本原则,试验数据应真实、完整、准确、可追溯,试验结果统计分析应科学合理。
本指导原则仅阐述皮肤光毒性试验需要重点关注的问题,试验时需对具体情况进行分析。
三、基本内容
(一)受试物的配制
当受试物为液体时,一般不做稀释,可以直接使用原液进行试验。当受试物为固体时,应将其研磨成细粉状并用水或其他溶剂充分湿润。若使用其他溶剂使受试物充分湿润,应考虑溶剂是否会对试验动物的皮肤产生刺激性影响。
对化妆品进行光毒性试验时,一般使用原霜或原液。可通过预试验,确定不引起受试动物皮肤刺激性反应的受试物浓度,在该浓度下对受试物进行试验。
(二)试验动物的选择
使用成年白色家兔或白化豚鼠作为试验动物,动物性别尽可能雌雄各半。正式试验的动物数为6只。
实验动物、环境、饲料、饮水等应符合《化妆品安全技术规范》的要求。
对试验动物的喂养选用标准配合饲料,自由饮水。需注意补充适量维生素C。
(三)光源
光源是光毒试验中的重要试验条件。当使用包括长波紫外线(UVA)和中波紫外线(UVB)的混合光源时,由UVB 引起的红斑与光毒性红斑相混可能产生假阳性结果,因此采用单纯UVA为照射光源以避免UVB对试验结果的干扰。
本试验中使用的光源为波长为320 nm-400 nm的UVA, UVB的剂量不得超过0.1 J/cm2。使用UVA光源前,用辐射计量仪在受试动物背部照射区设置6个点,对光强度(mW/ cm2)进行测定。一般照射剂量要求达到10 J/cm2,在此基础上可计算照射时间。
(四)试验设计
试验动物背部备4块去毛区,每块面积约2 cm×2 cm。试验部位的皮肤应无损坏及异常。固定动物并按照《化妆品安全技术规范》要求,分别在4块去毛区进行如下试验处理:涂受试物、不照射;涂受试物、照射;不涂受试物、不照射;不涂受试物、照射。
(五)阳性对照的设置
选择已知的光毒性物质作为阳性对照物进行试验,如8-甲氧基补骨脂。
为更好地对测试过程进行质量控制,至少每半年用阳性对照物检查一次以保证试验方法可靠性。
四、结果分析与评价
试验处理结束后分别于1 h、24 h、48 h、72 h观察皮肤反应,并对皮肤刺激反应进行评分。评分具体规则如下:
(1)观察红斑和焦痂形成情况:无红斑积分为0;轻微红斑(勉强可见),积分为1;明显红斑,积分为2;中度-重度红斑,积分为3;严重红斑(紫红色)至轻微焦痂形成,积分为4。
(2)观察水肿形成情况:无水肿积分为0;轻微水肿(勉强可见),积分为1;轻度水肿(皮肤隆起轮廓清楚),积分为2;中度水肿(皮肤隆起约1 mm),积分为3;重度水肿(皮肤隆起超过1 mm,范围扩大),积分为4。
皮肤刺激反应评分的最高积分为8。
单纯涂受试物而未经照射区域未出现皮肤反应,而涂受试物后经照射的区域出现皮肤反应分值之和为2或2以上的动物数为1只或1只以上时,判定受试物具有光毒性。
五、术语和释义
光毒性(phototoxicity)指皮肤一次接触化学物质后,继而暴露于紫外线照射下所引发的一种皮肤毒性反应,或者全身应用化学物质后,暴露于紫外线照射下发生的类似反应。
长波紫外线(UVA)指波长为320 nm-400 nm的紫外线。
中波紫外线(UVB)指波长为290 nm-320 nm的紫外线。
六、附录
试验方法可参照《化妆品安全技术规范》中收录的“皮肤光毒性试验”。
《皮肤光毒性试验技术指导原则(征求意见稿)》起草说明
为贯彻落实《化妆品监督管理条例》《化妆品注册备案管理办法》《化妆品注册备案资料管理规定》《化妆品新原料注册备案资料管理规定》等相关法规和技术标准要求,规范开展化妆品和新原料的毒理学检测,中国食品药品检定研究院(以下简称中检院)组织起草了《皮肤光毒性试验技术指导原则(征求意见稿)》(以下简称《技术指导原则(征求意见稿)》)。现将起草的有关情况说明如下:
一、起草的必要性
近年来,化妆品市场及相关行业蓬勃发展。但美化生活的同时,化妆品也可能出现一些毒副作用,如其中的紫外线吸收剂或添加剂(防腐剂、香精等)中的光活性物质经阳光照射后可能产生光毒性作用。根据《国家药监局关于发布实施化妆品注册和备案检验工作规范的公告(2019年 第72号)》要求,普通化妆品中化学防晒剂含量≥0.5%(w/w)的产品(淋洗类、香水类、指甲油类除外),特殊化妆品中防脱发类、祛斑美白类、防晒类及化学防晒剂含量≥0.5%(w/w)的产品(香水类、指甲油类除外)应进行皮肤光毒性试验。《化妆品新原料注册备案资料管理规定》要求,原料具有紫外线吸收特性需进行皮肤光毒性试验。为规范试验设计和相关技术要求,制定本《技术指导原则》(征求意见稿)以满足新法规下化妆品行业发展和监管需求。
二、制定原则
(一)依法依规原则。《技术指导原则(征求意见稿)》遵循依法依规原则,贯彻落实《化妆品监督管理条例》及配套法规文件的相关法规要求,研究化妆品原料及产品进行光毒性试验的的一般原则和具体要求,切实为化妆品毒理学检测提供技术指导,也为技术审评以及监管提供依据。
(二)公开透明原则。《技术指导原则(征求意见稿)》起草过程中,坚持“公开透明、广泛参与”原则,充分参考国内外相关法规和技术标准,积极征求毒理学领域专家意见,同时根据意见反馈情况科学合理地进行修改完善。
三、主要内容
《技术指导原则(征求意见稿)》主要内容包括制定背景和法规依据、适用范围和基本原则;试验基本内容如受试物的配制、试验动物的选择、光源、试验设计、阳性对照的设置;结果分析等。
四、需要说明的问题
(一)关于指导原则定位
本《技术指导原则(征求意见稿)》目的在于为化妆品光毒性试验技术提出科学性建议。
(二)关于适用范围
本《技术指导原则(征求意见稿)》适用于化妆品和新原料的光毒性研究及安全评估。
(三)关于测试要求
光毒性试验应按照规范程序、在符合相关资质要求的检验机构开展检测,可参照《化妆品安全技术规范》中收录的《皮肤光毒性试验》。
细菌回复突变试验技术指导原则(征求意见稿)
一、概述
细菌回复突变试验又称Ames试验,是一项检测基因突变的体外致突变性试验,通过检测受试物对微生物(细菌)的基因突变(注释1)作用,预测其遗传毒性和潜在的致癌作用。
细菌回复突变试验利用鼠伤寒沙门氏菌和大肠杆菌来检测点突变,涉及DNA的一个或几个碱基对的置换、插入或缺失(注释2)。鼠伤寒沙门氏菌和大肠杆菌的试验菌株分别为组氨酸缺陷突变型和色氨酸缺陷突变型,在无组氨酸或色氨酸的培养基上不能生长,在有组氨酸或色氨酸的培养基上才能正常生长。致突变物存在时可以回复突变为原养型,在无组氨酸或色氨酸的培养基上也可以生长。故可根据菌落形成数量来衡量受试物是否为致突变物。
某些致突变物需要代谢活化后才能使上述细菌产生回复突变,受试物要同时在有和没有代谢活化系统的条件下进行试验。
本指导原则依据《化妆品安全技术规范》《化妆品注册和备案检验工作规范》《化妆品注册备案资料管理规定》《化妆品新原料注册备案资料管理规定》等相关要求,并参考国内外相关指南制定。本指导原则适用于化妆品和化妆品新原料的研究及安全评估。
本指导原则是在现行法规和标准以及当前科学认知水平下制定的,随着法规和标准的更新完善,以及科学技术的发展,将适时进行调整。
二、基本原则
(一)试验管理
本指导原则所指的细菌回复突变试验属于化妆品安全性评价的毒理学研究,应在符合化妆品相关法规的前提下开展。
(二)具体问题具体分析
细菌回复突变试验的设计,应基于化妆品或化妆品原料自身特点、性质和使用情况,遵循“具体问题具体分析”的原则。根据受试物特点、现有数据、试验目的等选择合适的试验方法,设计适宜的试验方案,并结合其他毒理研究信息对试验结果进行全面的评价。
(三)随机、对照、重复
遗传毒性试验应符合毒理学试验随机、对照、重复的基本原则。
三、基本内容
(一)菌株
细菌回复突变试验至少应采用5种菌株,包括用于检测组氨酸靶基因中鸟嘌呤-胞嘧啶(G-C)位点碱基置换或移码突变的4种组氨酸营养缺陷型鼠伤寒沙门氏菌(TA98;TA100;TA1535;TA1537/TA97/ TA97a),以及用于检测组氨酸或色氨酸基因中腺嘌呤-胸腺嘧啶(A-T)位点碱基置换与检测交联剂的鼠伤寒沙门氏菌TA102或大肠杆菌WP2 uvrA或大肠杆菌WP2 uvrA(pKM101)。
新获得的或者长期保存的菌种,在试验前需要进行菌株的生物特性鉴定。鉴定的判断标准应满足《化妆品安全技术规范》的要求。
(二)代谢活化系统
一些具有致突变的物质需要代谢活化后才会引起细菌回复突变,因此细菌在加或不加代谢激活系统的情况下均应暴露于受试物。
最常用的代谢活化系统是用多氯联苯(PCB混合物)或用苯巴比妥和 β-萘黄酮组合处理的哺乳动物(大鼠)肝脏微粒体酶(S9)。S9在S9混合液中的浓度一般为5%~30%(v/v)。代谢活化系统的选择和条件取决于所测试化学物质的类别。在某些情况下,可能需要使用两种或两种以上浓度的S9;对于偶氮染料和重氮化合物,更适合使用还原性代谢活化系统。
(三)受试物的处理
受试物应采用工艺相对稳定、纯度和杂质含量能反映上市样品质量和安全性的样品。
在处理细菌之前,应将固体受试物溶解或悬浮在适当的溶剂或溶媒中,并在必要时进行稀释。液体受试物可以直接添加到测试系统中和/或在处理之前进行稀释。
受试物应新鲜配制,有资料表明其溶液或混悬液储存稳定者除外。
对于化妆品终产品,应按照产品使用方法配制受试物,并明确配制方法和使用浓度。如为染发产品,应按照产品使用方法或产品使用说明书中各剂型的配制比例进行配制,如有多种配制比例,则需进行多个比例受试物的配制。配制后的受试物如需进一步稀释,则应选用合适的溶剂并设阴性对照。
对于化妆品新原料,应根据原料的溶解性选择适宜的溶剂进行配制或稀释,并设阴性对照。
(四)溶剂的选择
所用溶剂应不与受试物发生反应,对试验菌株毒性低且无致突变性。首选灭菌蒸馏水/去离子水,对于不溶于水的受试物可选择其他溶剂,常用的有二甲基亚砜(DMSO)、丙酮、95%乙醇。
(五)最高浓度的确定
细菌回复突变试验中受试物的最高浓度主要取决于受试物对细菌的毒性和溶解度。细菌自发回变数的减少,背景菌变得清晰或被处理的培养物细菌存活数减少都是毒性的标志。
对原料而言,一般最高剂量组可为5mg/皿或5µL/皿。对产品而言,有杀菌作用的受试物,最高剂量可为最低抑菌浓度,无杀菌作用的受试物,最高剂量可为原液。受试物至少应设四个剂量组。每个剂量均做三个平行平板。
用细菌回复突变试验检测某些受试物时,在不溶解的浓度范围内也能检测出剂量相关性的遗传毒性。建议采用以下方法检测相对不溶的受试物:
如果沉淀不干扰计数,应对产生沉淀的浓度进行计数,且最高浓度不超过5mg/皿或5µL/皿。当未观察到细菌毒性时,应以产生沉淀的最低浓度作为计数的最高浓度;当观察到剂量相关的细菌毒性或诱变性时,应按可能产生毒性时的要求来确定最高浓度。
对于初始实验,应至少使用五种不同的可分析浓度的测试物质,各测试点之间的间隔约为。在研究剂量-反应关系时,可以适当缩小测试点之间间隔。
(六)对照组的设置
试验应同时设阳性对照组、溶剂对照组和未处理(空白)对照组,包括加和不加S9两种情况。
阳性对照物要根据采用的菌株进行选择,并选择合适的剂量以保证每次试验的有效性。
一般选择已知的阳性诱变剂,如《化妆品安全技术规范》中收录的叠氮化钠、2-氨基蒽、敌克松、苯并(a)芘等。
四、试验结果分析与评价
(一)数据处理
应及时对受试物各剂量组、空白对照(自发回变)、溶剂对照以及阳性对照的每皿回变菌落数进行记录,并计算平均值和标准偏差。
(二)结果评价
根据统计分析结果,受试物经5个试验菌株测定后,只要有一个试验菌株,无论在加S9或未加S9条件下,符合下列情形之一的可判定受试物在本试验系统中具有致突变阳性:
(1)受试物TA1535、TA1537、WP2uvrA的回变菌落数在任一剂量条件下是溶剂对照回变菌落数的三倍或三倍以上并有可重复性;
(2)受试物TA97、TA97a、TA98、TA100、TA102、WP2uvrA(pKM101)的回变菌落数在任一剂量条件下是溶剂对照回变菌落数的二倍或二倍以上并有可重复性;
(3)受试物TA1535、TA1537、WP2uvrA的回变菌落数是溶剂对照回变菌落数的三倍或三倍以上并呈剂量-反应关系;
(4)受试物TA97、TA97a、TA98、TA100、TA102、WP2uvrA(pKM101)的回变菌落数是溶剂对照回变菌落数的二倍或二倍以上并呈剂量-反应关系。
如果受试物经五个试验菌株检测后,无论加S9和未加S9均为阴性,则可判定该受试物为致突变阴性。
(三)结果分析与解释
试验结果的生物学相关性为首要考虑因素,试验结果的统计学意义不应作为评判阳性反应的唯一因素。细菌回复突变试验出现阳性结果,应考虑受试物的纯度,以确定阳性结果是否污染物所致。氨基酸(组氨酸或色氨酸)污染可能导致菌落数的升高而出现假阳性结果。
细菌回复突变试验阳性结果常出现在最低抑菌浓度和最高非抑菌浓度的范围内,因此当试验中出现可疑阳性时,应通过改变试验条件(如调整受试物或S9浓度,改变培养条件等),对可疑阳性的受试物进行重复试验,确保试验结果的可靠性和准确性。
当细菌回复突变试验对某类受试物的潜在致突变性不敏感时,体外哺乳动物细胞基因突变试验可作为很好的替代和补充。
五、参考文献
1.国家药品监督管理局.化妆品安全技术规范.2015.
2. OECD. Guideline for testing of chemicals No.471: Bacterial reverse mutation test. 2020.
3.国家食品药品监督管理总局. 药物遗传毒性研究技术指导原则 [S]. 2018.
4.中华人民共和国国家卫生和计划生育委员会. 食品安
全国家标准 细菌回复突变试验: GB 15193.4-2014[S]. 北京: 中国标准出版社, 2015.
六、注释
基因突变:在化学致突变物作用下细胞DNA中碱基对的排列顺序发生变化。
碱基置换突变:引起DNA链上一个或几个碱基对的置换。
移码突变:引起DNA链上增加或缺失一个或多个碱基对。
碱基置换:有转换(transition)和颠换(transversion)两种形式。转换是DNA链上的一个嘧啶被另一嘧啶所替代,或一个嘌呤被另一嘌呤所代替。颠换是DNA链上的一个嘧啶被另一嘌呤所替代,或一个嘌呤被另一嘧啶所代替。
《细菌回复突变试验技术指导原则(征求意见稿)》起草说明
为规范开展化妆品和化妆品新原料的安全评价工作,保障消费者用妆安全,促进化妆品行业高质量发展,指导注册人、备案人开展化妆品以及化妆品新原料的研究,根据《化妆品监督管理条例》《化妆品注册备案管理办法》《化妆品注册备案资料管理规定》《化妆品新原料注册备案资料管理规定》及相关法律法规、强制性国家标准和技术规范的要求,中国食品药品检定研究院(以下简称中检院)组织起草了《细菌回复突变试验技术指导原则(征求意见稿)》(以下简称《技术指导原则(征求意见稿)》)。现将起草的有关情况说明如下:
一、起草的必要性
2021年5月1日,《化妆品监督管理条例》和相关配套法规已正式施行。《化妆品注册备案资料管理规定》《化妆品注册和备案检验工作规范》规定“细菌回复突变试验”为防脱发类和染发类特殊化妆品的一项注册检验项目;《化妆品新原料注册备案资料管理规定》中关于新原料是否具有致突变性评价时可应用该项试验进行检测或评估;另外,化妆品安全评估报告中,关于化妆品原料致突变性的评估也通常采用该项试验的数据作为原料评估的证据。在对该项试验的检验报告或毒理学试验资料进行审评时,发现存在试验中受试物最高浓度设置错误或试验结果判定不合理等情况。因此,中检院制定《技术指导原则》(征求意见稿),以规范应用细菌回复突变试验评价化妆品和新原料的致突变性。
二、制定原则
(一)依法依规原则。《技术指导原则(征求意见稿)》遵循依法依规原则,贯彻落实《化妆品监督管理条例》及配套法规文件中关于化妆品和新原料的法规要求,研究细菌回复突变试验的具体要求,切实为化妆品和新原料的安全评价提供技术指导,也为技术审评以及监管提供依据。
(二)公开透明原则。《技术指导原则(征求意见稿)》起草过程中,坚持“公开透明、广泛参与”原则,充分参考国内外相关法规和技术标准,积极征求监管部门、专家、行业协会意见,同时根据意见反馈情况科学合理地进行修改完善。
三、主要内容
《技术指导原则(征求意见稿)》主要内容包括概述;基本原则;试验中采用的菌株、采用的代谢活化系统;受试物处理、溶剂选择、试验最高浓度的确定、对照组的设置;试验结果分析与评价等原则。
四、需要说明的问题
(一)试验阳性结果分析
细菌回复突变试验试验出现阳性结果,应考虑受试物的纯度,以确定阳性结果是否为污染物所致。《技术指导原则(征求意见稿)》参考《药物遗传毒性研究技术指导原则》([S].2018)明确氨基酸(组氨酸或色氨酸)污染可能导致菌落数的升高而出现假阳性结果。同时参考 OECD TG471相关内容,指出当试验中出现可疑阳性时,应通过改变试验条件,如调整受试物或S9浓度,改变培养条件等,确保试验结果的可靠性和准确性。
人体皮肤斑贴试验技术指导原则(征求意见稿)
一、概述
部分人群在使用化妆品后,皮肤可能会产生多种不良反应。人体皮肤斑贴试验可用于检测受试物引起人体皮肤不良反应的潜在可能性。根据《化妆品注册备案资料管理规定》《化妆品注册和备案检验工作规范》(以下简称《检验工作规范》)等法规要求,部分化妆品(如祛斑美白类和防晒类化妆品)在上市前需进行人体皮肤斑贴试验。本指导原则中的人体皮肤斑贴试验包括皮肤封闭型斑贴试验和皮肤重复性开放型涂抹试验。一般情况下采用皮肤封闭型斑贴试验,当出现刺激性结果难以判断时,可增加皮肤重复性开放型涂抹试验。
本指导原则旨在为化妆品产品在申请注册开展人体皮肤斑贴试验时提供技术指导,适用于化妆品的人体安全性评价,检测化妆品产品对人体皮肤潜在的不良反应。本指导原则是在遵循《化妆品安全技术规范》(以下简称《安全技术规范》)《检验工作规范》的基础上,结合审评工作实践,对人体皮肤斑贴试验设计的关键内容进行阐述,重点阐述人体皮肤斑贴试验开展的基本原则,受试者、受试物、对照的选择原则,以及对于所获得结果的分析及评价要求。
本指导原则是在现行法规和标准以及当前科学认知水平下制定的,随着法规和标准的更新完善,以及科学技术的发展,将适时进行调整。
二、基本原则
(一)检验管理
人体皮肤斑贴试验应符合《检验工作规范》及相关法规要求,包括检验机构资质、检验机构选择、检验方法、检验程序、结果分析、报告体例等。
(二)人体安全检验基本原则
化妆品人体皮肤斑贴试验应当遵守伦理学原则,要求受试者签署知情同意书并采取必要的医学防护措施,最大程度地保护受试者的利益。试验之前应先完成必要的产品安全性评价并出具书面证明,安全性评价不合格的产品不再进行人体检验。
三、基本内容
应按照《安全技术规范》中收录的《人体皮肤斑贴试验》方法开展化妆品产品的人体安全性评价,并重点关注以下内容。
(一)受试者选择
受试者的入选和排除标准应符合《安全技术规范》的要求。受试者年龄应选择18-60岁之间的志愿者,近一周未使用抗组胺药或近一个月内未使用免疫抑制剂,近两个月内受试部位未应用任何抗炎药物。应排除患有炎症性皮肤病临床未愈者、胰岛素依赖性糖尿病患者、正在接受治疗的哮喘或其他慢性呼吸系统疾病患者、在近6个月内接受抗癌化疗者、免疫缺陷或自身免疫性疾病患者、哺乳期或妊娠妇女、双侧乳房切除及双侧腋下淋巴结切除者及在皮肤待试部位由于瘢痕、色素、萎缩、鲜红斑痣或其他瑕疵而影响试验结果的判定者。此外,参加其他的临床试验研究者、体质高度敏感者及非志愿参加者或不能按试验要求完成规定内容者也应排除。
(二)受试物要求
1、受试物应用形式
应根据产品配方、剂型及使用特点等,结合产品使用方法选择合适的受试物应用形式,并在检验报告中根据受试物的实际应用形式对受试物进行清晰描述。例如,贴片式面膜类产品,可以根据实际应用形式在报告中清晰描述受试物的施用面积、取样量、颜色和物态等信息。例如,对于无色透明液体内含白色无纺布的面膜,可以描述为“不超过50mm2的圆形受试物(约0.020g~0.025g液体浸湿的白色无纺布)”等,具体可根据试验中实际取样形式进行描述。
受试物可选择化妆品终产品原物或稀释物等,选择稀释物应注明赋形剂和浓度。如在进行皮肤封闭斑贴试验时,贴片式面膜类产品可选择同斑试器小室面积和深度大小的受试物;粉饼类产品一般情况下选择原物作为受试物,使用电子天平称取原物0.020~0.025g,散粉类产品可选择适量的白凡士林或类似属性的物质作为稀释剂,稀释浓度可选择50%;一些淋洗类产品可根据产品的具体使用方法确定受试物浓度。此外,当产品包含两个或两个以上部分,应结合具体使用方法判断受试物的应用形式。其中,使用方法为混合后使用的,还应明确受试物的混合比例(无法分别取样的产品除外),使用方法为分开使用的,受试物应根据各部分单独使用的方法进行选择。
2、受试物批号
在开展人体皮肤斑贴试验时,应按照《检验工作规范》要求,选择与微生物理化检验报告、毒理学试验报告同一批号的产品进行试验。
(三)对照的设置
进行人体皮肤斑贴试验过程中,应同时设置对照组。当受试物选择化妆品产品原物时,对照孔或部位不使用任何物质,为空白对照,皮肤封闭型斑贴试验若需使用滤纸还应设置空白滤纸对照;选择稀释后的化妆品时,对照孔或部位使用该化妆品的稀释剂。
四、结果分析与评价
人体皮肤斑贴试验是化妆品安全评价的一个重要组成,其最终目的在于检测受试物引起人体皮肤不良反应的潜在可能性,试验结果的分析与评价是试验的必要组成部分,应对试验结果进行科学和全面的分析与评价。受试者个体皮肤反应结果判定以所有观察时点的最高皮肤反应程度计,产品结果以至少30例受试者中出现不同反应程度相应例数的总和为依据。
(一)试验结果的影响因素
多种因素可影响人体皮肤斑贴试验结果的准确性和可重复性,如斑贴时间、季节、受试物的刺激强度、剂型、测试部位及皮肤状况等。例如,进行皮肤封闭型斑贴试验时应保持斑贴受试物贴敷在皮肤上24小时,试验部位要标记,胶带粘贴一定要贴合,以免出现假阴性结果。应选用规范的斑试材料,减少由于对斑试器过敏造成的假阳性。对于试验测试部位应按照《安全技术规范》要求,皮肤封闭型斑贴试验为背部或前臂屈侧,重复性开放型涂抹试验为前臂屈侧。开展试验时,应综合考虑可能的影响因素,保证试验结果的科学性、真实性、可靠性。
(二)试验结果的判定
皮肤封闭型斑贴试验按照《安全技术规范》中载明的标准观察有无红斑、浸润、水肿、丘疹、疱疹、融合性疱疹等皮肤反应,根据观察结果进行评分划分皮肤反应分级,并记录结果。
重复性开放型涂抹试验按照《安全技术规范》中载明的标准观察有无红斑、皮肤干燥、皱褶、水肿、丘疹、风团、脱屑、裂隙、水疱、大疱、糜烂、色素沉着或色素减退、痤疮样改变等皮肤反应,根据观察结果进行评分划分皮肤反应分级,并记录结果。
(三)化妆品终产品的结果评价
在所有受试者中,各级皮肤反应只要达到一定数量则可判定受试物对人体有皮肤不良反应。
1、皮肤封闭型斑贴试验评价原则
30例受试者中,出现1级皮肤不良反应的人数不得多于5例(不含5例,下同),或2级皮肤不良反应的人数不得多于2例(除臭产品斑贴试验1级皮肤不良反应的人数不得多于10例,2级皮肤不良反应的人数不得多于5例),或不得出现1例3级或3级以上皮肤不良反应。若超出上述原则要求,提示该受试物可能会对人体皮肤产生不良反应。
封闭型斑贴试验出现刺激性结果或结果难以判断时,可增加皮肤重复性开放型涂抹试验,进一步对皮肤封闭型斑贴试验结果进行验证。例如,当出现1级皮肤不良反应人数3例,同时出现2级皮肤不良反应的人数2例时,可以增加皮肤重复性开放型涂抹试验。
儿童化妆品的评价按照《儿童化妆品技术指导原则》进行。
2、皮肤重复性开放型涂抹试验评价原则
30例受试者中1级皮肤不良反应不得多于5例(含5例,下同),2级皮肤不良反应不得多于2例,或不得出现3级或3级以上皮肤不良反应1例以上。若超出上述原则要求,提示该受试物可能会对人体皮肤产生不良反应。
儿童化妆品的评价按照《儿童化妆品技术指导原则》进行。
《人体皮肤斑贴试验技术指导原则(征求意见稿)》起草说明
为规范开展化妆品安全评价工作,根据《化妆品监督管理条例》《化妆品注册备案管理办法》《化妆品注册备案资料管理规定》及相关法律法规、强制性国家标准和技术规范的要求,中国食品药品检定研究院(以下称中检院)组织起草了《人体皮肤斑贴试验技术指导原则(征求意见稿)》(以下称《技术指导原则(征求意见稿)》)。现将起草的有关情况说明如下:
一、必要性
人体皮肤斑贴试验是化妆品安全评价的一个重要组成,其最终目的在于检测受试物引起人体皮肤不良反应的潜在可能性。但在化妆品注册过程中发现,部分产品的人体皮肤斑贴试验存在受试物描述不清、未结合产品使用方法选择受试物、产品批号不一致等情况。因此,有必要对试验相关技术要求进行全面分析,制定专门的技术指导原则。中检院制定《技术指导原则(征求意见稿)》,对人体皮肤斑贴试验设计的关键内容进行阐述,并对试验中的重点环节提出技术指导,同时增加产品的安全评价原则,为新法规背景下化妆品产业的高质量发展提供技术支撑,以满足化妆品行业发展和监管需求。
二、制定原则
(一)依法依规原则。《技术指导原则(征求意见稿)》遵循依法依规原则,整合《化妆品安全技术规范》及《化妆品注册和备案检验工作规范》等文件中关于人体皮肤斑贴试验的有关内容,研究人体皮肤斑贴试验设计和产品评价的具体要求,以规范和指导化妆品产品的安全评价工作。
(二)落实细化原则。《技术指导原则(征求意见稿)》结合具体审评实践,在符合《化妆品安全技术规范》《化妆品注册和备案检验工作规范》等相关规范性文件基础上,进一步细化人体皮肤斑贴试验的具体要求及化妆品终产品的安全评价原则,以增加可操作性,切实为企业产品的注册申请提供技术指导,也为技术审评以及监督管理提供参考。
(三)公开透明原则。《技术指导原则(征求意见稿)》起草过程中,坚持“公开透明、广泛参与”原则,充分参考国内外相关法规和指导原则,积极征求监管部门、检验机构、专家、行业协会意见,同时根据意见反馈情况科学合理地对指导原则予以完善。
三、主要内容
《指导原则(征求意见稿)》正文共包括4个部分,包括概述、基本原则、基本内容、结果分析与评价等。
四、需要说明的问题
(一)关于适用范围
本指导原则旨在为化妆品的人体皮肤斑贴试验设计及结果评价提供技术指导,同时为药品监督管理部门审评工作提供技术参考,适用于申请注册化妆品的人体安全性评价。
(二)关于受试物的选择
随着科技手段的不断发展,化妆品研发的创新,化妆品的剂型及包装形式越来越多样化,因此产品的使用方法也随之呈现多元化。为进一步规范和细化人体皮肤斑贴试验中的受试物的配制,《技术指导原则(征求意见稿)》对试验中的受试物进行了进一步的细化,提出一般要求后,以举例形式对常见的一些化妆品剂型的受试物应用形式进行了阐述,如贴片式面膜和粉饼类产品等。
(三)关于化妆品终产品的安全评价原则
《化妆品安全技术规范》中包含了对人体皮肤斑贴试验的结果判定,为进一步规范和指导化妆品的安全评价工作,《技术指导原则(征求意见稿)》中,增加了化妆品终产品的结果评价,对受试物造成人体皮肤出现潜在不良反应的受试者数量进行了界定。
人体安全性试用试验技术指导原则(征求意见稿)
一、概述
化妆品人体试用试验是让受试者按照产品使用方法直接使用化妆品,并持续观察受试者有无皮肤不良反应,从而发现受试化妆品引起人体皮肤不良反应的潜在可能性。该方法是化妆品终产品安全性评价体系中至关重要的组成部分,适用于防脱发类、脱毛类、理化检验结果pH≤3.5或企业标准中设定pH≤3.5的驻留类化妆品及其他需要类似检验的化妆品。
本指导原则依据《化妆品安全技术规范》《化妆品注册和备案检验工作规范》《化妆品注册备案资料管理规定》等相关要求,并参考国内外相关指南制定。本指导原则适用于化妆品的研究及安全评估。
本指导原则是在现行法规和标准以及当前科学认知水平下制定的,随着法规和标准的更新完善,以及科学技术的发展,将适时进行调整。
二、基本原则
1. 化妆品人体试用试验应当依据我国《化妆品安全技术规范》和《化妆品注册和备案检验工作规范》等要求进行。
2. 化妆品人体试用试验之前应先完成必要的产品安全性评价并出具书面证明,安全性评价不合格的产品不再进行人体试用试验。
3. 化妆品人体试用试验应当遵守伦理学原则,要求受试者签署知情同意书并采取必要的医学防护措施,最大程度地保护受试者的利益。
4. 试验数据应真实、完整、准确、可追溯,试验结果统计分析应科学合理。
三、基本内容
应按照《化妆品安全技术规范》中收录的《人体试用试验安全性评价》方法开展化妆品产品的人体安全性评价,并重点关注以下内容。
(一)受试者选择
1. 选择符合试验要求的18~60岁志愿者作为受试对象。
2. 受试者数量不得少于30人。
3. 不能选择有下列情况者作为受试者:(1)近一周使用抗组胺药或近一个月内使用免疫抑制剂者;(2)近两个月内受试部位应用任何抗炎药物者;(3)受试者患有炎症性皮肤病临床未愈者;(4)胰岛素依赖性糖尿病患者;(5)正在接受治疗的哮喘或其他慢性呼吸系统疾病患者;(6)在近6个月内接受抗癌化疗者;(7)免疫缺陷或自身免疫性疾病患者;(8)哺乳期或妊娠妇女;(9)双侧乳房切除及双侧腋下淋巴结切除者;(10)在皮肤待试部位由于瘢痕、色素、萎缩、鲜红斑痣或其他瑕疵而影响试验结果的判定者;(11)参加其他的临床试验者;(12)体质高度敏感者;(13)非志愿参加者或不能按试验要求完成规定内容者。
(二)受试物试用
按照化妆品产品标签注明的使用方法和注意事项让受试者直接使用受试产品。受试物应注明样品名称、生产批号、生产企业、使用期限等信息。
(三)皮肤不良反应记录
非单次使用的试验产品(如防脱发类化妆品)使用后 1 周、4 周和试验结束时至检验机构现场观察受试者有无皮肤不良反应,期间可每周 1 次观察或电话随访受试者有无皮肤反应的情况,按照《化妆品安全技术规范》中载明的标准观察有无红斑、浸润、水肿、丘疹、水疱、大疱等皮肤反应并记录结果。产品试用时间一般不得少于 4 周。
四、结果分析与评价
根据人体试用试验的结果,结合不同类别化妆品的特点,分析与评价受试化妆品引起人体皮肤不良反应的潜在可能性。
1.脱毛类化妆品:如果30例受试者中出现3例以上(不含3例,下同)1级皮肤不良反应,或2级皮肤不良反应的人数多于2例,或出现1例3级及3级以上皮肤不良反应,提示该受试化妆品引起人体皮肤不良反应的潜在可能性比较高,对人体存在较高的安全风险。
2.防脱发类化妆品及pH≤3.5的驻留类化妆品:如果30例受试者中出现2例以上(不含2例,下同)1级皮肤不良反应,或2级皮肤不良反应的人数多于1例,或出现1例3级及3级以上皮肤不良反应,提示该受试化妆品引起人体皮肤不良反应的潜在可能性比较高,对人体存在较高的安全风险。
五、参考文献
1. 国家药品监督管理局.化妆品安全技术规范.2015.
2. 国家药品监督管理局.化妆品注册和备案检验工作规范.2019.
3. 国家食品药品监督管理总局.化妆品技术审评指南.2010.
《人体安全性试用试验技术指导原则(征求意见稿)》起草说明
为规范开展化妆品安全评价工作,根据《化妆品监督管理条例》《化妆品注册备案管理办法》《化妆品注册备案资料管理规定》及相关法律法规、强制性国家标准和技术规范的要求,中国食品药品检定研究院(以下称中检院)组织起草了《人体试用试验技术指导原则(征求意见稿)》(以下称《技术指导原则(征求意见稿)》)。现将起草的有关情况说明如下:
一、必要性
人体试用试验是化妆品安全评价的重要组成部分,其最终目的在于检测化妆品受试物引起人体皮肤不良反应的潜在可能性。但在化妆品注册和备案过程中发现,部分产品的人体试用试验存在受试物描述不清、产品批号不一致等情况。因此,有必要对试验相关技术要求进行全面分析,制定专门的技术指导原则。中检院制定《指导原则(征求意见稿)》,对化妆品人体试用试验设计的关键内容进行阐述,对试验中的重点环节提出技术指导,并增加产品的安全评价原则,为新法规背景下化妆品产业的高质量发展提供技术支撑,以满足化妆品行业发展和监管需求。
二、制定原则
(一)依法依规原则。《指导原则(征求意见稿)》遵循依法依规原则,整合《化妆品安全技术规范》《化妆品注册和备案检验工作规范》等文件中关于人体试用试验的有关要求,并对试验设计的关键内容进行阐述,以方便注册人、备案人、检验机构以及监管部门使用。
(二)落实细化原则。《指导原则(征求意见稿)》结合具体审评实践,在符合《化妆品安全技术规范》《化妆品注册和备案检验工作规范》等相关规范性文件基础上,进一步明确人体试用试验的具体要求及结果分析与评价原则,以增加可操作性,切实为化妆品申请注册和进行备案提供技术指导,也为技术审评以及监督管理提供依据。
(三)公开透明原则。《指导原则(征求意见稿)》起草过程中,坚持“公开透明、广泛参与”原则,充分参考国内外相关法规和指导原则,积极征求检验机构、专家、行业协会意见,同时根据意见反馈情况对指导原则予以完善。
三、主要内容
《指导原则(征求意见稿)》正文共包括5个部分:第一部分为概述,第二部分为基本原则,第三部分为基本内容,第四部分为结果分析与评价,第五部分为参考文献。
四、需要说明的问题
(一)关于适用范围
本指导原则旨在为化妆品产品在申请注册和进行备案开展人体试用试验时提供技术指导,同时为化妆品监督管理部门审评工作提供技术参考,适用于申请注册和进行备案化妆品产品的人体安全性评价。
(二)关于化妆品产品的安全评价
《化妆品安全技术规范》中包含了人体试用试验的试验方法和评分标准,为进一步规范和指导化妆品的安全评价工作,《指导原则(征求意见稿)》中,根据人体试用试验结果,分析与评价受试化妆品引起人体皮肤不良反应的潜在可能性,为化妆品注册人、备案人、检验机构及监管部门提供参考。
防晒化妆品长波紫外线防护指数(PFA值)检测技术指导原则(征求意见稿)
一、概述
阳光中紫外线的波长范围为200 nm-400 nm,其中200 nm-290 nm波长的为短波紫外线(UVC),290 nm-320 nm波长的为中波紫外线(UVB),320 nm-400 nm波长的为长波紫外线(UVA),到达地球表面的为UVB和UVA。UVA能造成皮肤损伤,评估防晒化妆品是否具有防护长波紫外线(UVA)照射的功效,可以进行长波紫外线防护指数(PFA值)的测定。根据《化妆品注册备案资料管理规定》《国家药监局关于发布实施化妆品注册和备案检验工作规范的公告(2019年 第72号)》等法规规定,标注PFA值或PA+~PA++++的产品,需要检测PFA值;宣称UVA防护效果或宣称广谱防晒的产品,需要检测化妆品抗UVA能力参数—临界波长或PFA值。
本指导原则适用于防晒化妆品的长波紫外线防护指数(PFA值)检测技术研究和结果评价。
本指导原则依据《化妆品安全技术规范》《化妆品注册备案资料管理规定》《化妆品注册和备案检验工作规范》等要求制定。本指导原则的使用应遵守我国的相关法律、法规和规章。
本指导原则是在现行法规和标准以及当前科学认知水平下制定的,随着科学研究的进展,本指导原则中的相关内容将不断完善与更新。
二、基本原则
防晒化妆品长波紫外线防护指数(PFA值)检测属于注册备案检验中的功效评价检验项目,其试验设计应科学、合理,检验方法、检验结果分析与评价、检验报告体例等应符合《化妆品安全技术规范》、《化妆品注册和备案检验工作规范》等相关法规的规定。
常采用人体试验对防晒化妆品长波紫外线防护指数(PFA值)进行检测,试验应遵守伦理学原则要求。试验前应当先完成防晒化妆品的理化微生物检验、毒理学试验、人体斑贴试验并出具书面报告。对于理化微生物检验、毒理学试验、人体斑贴试验结果不符合要求的防晒化妆品不应进行长波紫外线防护指数(PFA值)检验。所有参加该项试验的受试者或消费者签署知情同意书后方可开展试验。
三、基本内容
(一)紫外线光源
使用可发射接近日光的UVA区连续光谱的光源。应配有恰当的光学过滤系统,将波长短于320 nm的紫外线过滤除去以免造成紫外灼伤;波长大于400 nm的可见光和红外线须小于光源输出能量的5%,以免引起黑化效应和致热效应。
光源应稳定输出,在整个光束截面上应均一。单个光斑的最小辐照面积应大于或等于0.5 cm2。此外,对光源的监测和维护应符合《化妆品安全技术规范》要求。
(二)受试者选择
在皮肤类型的选择方面,应选择18-60岁且皮肤分型为III或IV型的健康志愿受试者,男女不限,所有受试者的个体类型角值应在18°-43°。受试者不应有光敏性皮肤病史等。
在试验部位的选择方面,选择人体后背为试验部位。受试部位皮肤应无色素痣或其他色斑等,皮肤色泽呈均一状态。
在测试人数方面,要求每种防晒化妆品的测试人数有效例数至少为10,最大有效例数为20;每组数据的淘汰例数最多不能超过5例。因此每组参加测试的人数最多不能超过 25 人。在检验报告中,应说明受试者的基本情况,包括总人数、姓名首字母、性别、年龄和平均年龄等。
(三)PFA值标准品的制备
为更好地对测试过程进行质量控制,保证试验结果的有效性、一致性,对防晒产品PFA值进行测定时,应同时对标准品的PFA值进行测定。应按照《化妆品安全技术规范》收录的配方和方法,进行PFA值标准品的制备。防晒化妆品的PFA 值<12 时,可选择低PFA 值标准品;防晒化妆品的PFA 值≥12 时,可选择高PFA 值标准品。高PFA 值标准品可用于任何产品测试,每次测试只需参考一种标准品配方。
在PFA值检验报告中,应写明所用标准品的PFA理论值,并分别列出被测物和标准品的PFA值测定结果。
(三)最小持续性黑化量的测定
在对最小持续性黑化量进行测定时,应严格按照《化妆品安全技术规范》所规定的程序和步骤,并符合相关技术要求。受试者可采取俯卧位或前倾位,光源照射于后背的部位。
按(2.00±0.05)mg/cm2的用量称取样品。样品涂抹时应按照实际使用的方式进行,将样品准确、均匀地涂抹在受试部位皮肤上。样品涂抹面积不小于30 cm2,例如涂抹面积为30 cm2时,则使用的样品总量应在58.5-61.5 mg范围内。推荐使用乳胶指套将样品均匀涂抹于试验区内(对于使用乳胶指套涂抹均匀难度大的粘性较强产品、粉状产品等可直接使用手指涂抹,并注意每次涂抹前洗净手指)。涂抹样品后应等待15-30 min。
在测试产品前应完成受试者最小持续性黑化量的预测。
在试验当日需同时测定下列三种情况下的最小持续性黑化量值:
1.受试者的最小持续性黑化量:根据预测的最小持续性黑化量值调整紫外线照射剂量,在试验当日再次测定受试者未防护皮肤的最小持续性黑化量。
2.在产品防护情况下皮肤的最小持续性黑化量:将受试的防晒化妆品涂抹于受试者皮肤,根据预测的最小持续性黑化量值和预估的PFA值确定照射剂量后测定。
3.在标准品防护情况下皮肤的最小持续性黑化量:将PFA值标准品涂抹于受试部位,根据预测的最小持续性黑化量值和标准品的PFA值确定照射剂量后测定。
四、结果分析与评价
(一)计算公式
PFA=使用防晒化妆品防护皮肤的最小持续性黑化量/未防护皮肤的最小持续性黑化量
(二)统计及结果分析
在试验当日测定三种情况下的最小持续性黑化量值时,如全部试验点均未出现黑化,或全部试验点均出现黑化,或试验点黑化随机出现时,应判定结果无效,需重新测定。
对个体PFA值的计算要求精确到小数点后一位数字。计算样品防护全部受试者PFA值的算数均数,取其整数部分即为受试物的PFA值。均数的95%可信区间不超过均数的17%,否则应增加受试者人数(不超过25)至符合要求。标准品测定的PFA值必须位于可接受限值范围内。
(三)综合评价
根据PFA值测定结果,对防晒化妆品的长波紫外线防护能力进行评价。《防晒化妆品防晒效果标识管理要求》规定,UVA防护效果的标识应当以PFA值的实际测定结果为依据,在产品标签上标识UVA防护等级PA。当PFA值小于2时,不得标识UVA防护效果;当PFA值为2~3时,标识为PA+;当PFA值为4~7时,标识为PA++;当PFA值为8~15时,标识为PA+++;当PFA值大于等于16时,标识为PA++++。应根据《化妆品标签管理办法》《防晒化妆品防晒效果标识管理要求》及相关法规要求,进行与之相匹配的防晒效果宣称。
五、术语和释义
1.UVA防护指数(Protection Factor of UVA,PFA):引起被防晒化妆品防护的皮肤产生黑化所需的最小持续性黑化量与未被防护的皮肤产生黑化所需的最小持续性黑化量之比。
2.最小持续性黑化量(Minimal Persistent pigment darkening dose,MPPD):辐照后2-4 h在整个照射部位皮肤上产生轻微黑化所需要的最小紫外线辐照剂量或最短辐照时间。
3.个体类型角(individual type angle,ITA°):通过皮肤色度计或反射分光光度计测量皮肤L*a*b*颜色空间数据来表示人体皮肤颜色的参数。
六、附录
试验方法可参照《化妆品安全技术规范》第八章收录的“防晒化妆品长波紫外线防护指数(PFA值)测定方法”。
《防晒化妆品长波紫外线防护指数(PFA值)检测技术指导原则(征求意见稿)》起草说明
为贯彻落实《化妆品监督管理条例》《化妆品注册备案管理办法》《化妆品注册备案资料管理规定》等相关法规和技术标准要求,规范开展防晒化妆品长波紫外线防护指数(PFA值)检测,中国食品药品检定研究院(以下简称中检院)组织起草了《防晒化妆品长波紫外线防护指数(PFA值)检测技术指导原则(征求意见稿)》(以下简称《技术指导原则(征求意见稿)》)。现将起草的有关情况说明如下:
一、起草的必要性
阳光中主要有可见光、红外线和紫外线,紫外线可分为短波紫外线(UVC)、中波紫外线(UVB)、长波紫外线(UVA)。UVA能造成多种皮肤损伤,引起人们关注,在防晒产品中同时添加UVA吸收剂以使产品对较宽光谱的紫外线具有防护作用。《国家药监局关于发布实施化妆品注册和备案检验工作规范的公告(2019年 第72号)》中规定,标注PFA值或PA+~PA++++的产品,需要检测长波紫外线防护指数(PFA值);宣称UVA防护效果或宣称广谱防晒的产品,需要检测化妆品抗UVA能力参数—临界波长或PFA值。为规范试验设计和相关技术要求,制定本《技术指导原则》(征求意见稿)以满足新法规下化妆品行业发展和监管需求。
二、制定原则
(一)依法依规原则。《技术指导原则(征求意见稿)》遵循依法依规原则,贯彻落实《化妆品监督管理条例》及配套法规文件的相关法规要求,研究防晒化妆品长波紫外线防护指数(PFA值)检测的一般原则和具体要求,切实为防晒化妆品功效评价试验提供技术指导,也为技术审评以及监管提供依据。
(二)公开透明原则。《技术指导原则(征求意见稿)》起草过程中,坚持“公开透明、广泛参与”原则,充分参考国内外相关法规和技术标准,积极征求相关领域专家意见,同时根据意见反馈情况科学合理地进行修改完善。
三、主要内容
《技术指导原则(征求意见稿)》主要内容包括制定背景和法规依据、适用范围和基本原则;试验基本内容如紫外线光源、受试者选择、标准品的制备、最小持续性黑化量的测定;结果分析等。
四、需要说明的问题
(一)关于指导原则定位
该《技术指导原则(征求意见稿)》目的在于为防晒化妆品长波紫外线防护指数(PFA值)检测、检测结果分析与评价、防晒化妆品长波紫外线防护指数(PFA值)的规范化宣称提出科学性建议。
(二)关于适用范围
本《技术指导原则(征求意见稿)》适用于防晒化妆品的长波紫外线防护指数(PFA值)检测,以及对相关检验结果的评价。
(三)关于测试要求
防晒化妆品长波紫外线防护指数(PFA值)检测属于注册检验事项,应符合《化妆品注册和备案检验工作规范》及相关法规要求,按照规范程序、在符合相关资质要求的检验机构开展检测,并应采用《化妆品安全技术规范》中收录的《防晒化妆品的长波紫外线防护指数(PFA值)测定方法》。
相关推荐
CIO提供以下相关文库下载、合规服务以及线上培训课程学习。
热门推荐
最新推荐

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

医疗机构制剂注册备案
1.CIO为医疗机构配制制剂提供一站式合规服务。 2.帮助医疗机构取得医疗机构制剂注册批件。 3.价格合理,服务更省心。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

医疗器械互联网信息服务备案
自2025年1月20日起,国家药监局将“药品、医疗器械互联网信息服务审批”改为备案管理。我们为自建网站或平台销售医疗器械的企业提供专业的医疗器械互联网信息服务备案咨询服务,帮助企业高效完成备案。

药品互联网信息服务备案
自2025年1月20日起,药品和医疗器械互联网信息服务审批不再需要前置审批,转而实行备案管理。我们致力于为药企提供高效、专业的药品互联网信息服务备案服务,帮助客户顺利开展网络销售业务。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。






