2014—2021年创新医疗器械审批数据盘点
全国
创新医疗器械特别审查程序是针对具有核心技术发明专利、国际领先、国内首创、具有显著的临床应用价值等情形的医疗器械,采取按照早期介入、专人负责、科学审查的原则,在标准不降低、程序不减少的前提下,对创新医疗器械予以优先办理,并加强与申请人的沟通交流。2014 年,国家药监部门出台《创新医疗器械特别审批程序(试行)》。2018年,《创新医疗器械特别审批程序(试行)》修订为《创新医疗器械特别审查程序》。截至2021年12月31日,共有351个医疗器械进入创新医疗器械特别审查程序,其中113家企业的134个创新医疗器械获批上市。
特别审查激发创新活力
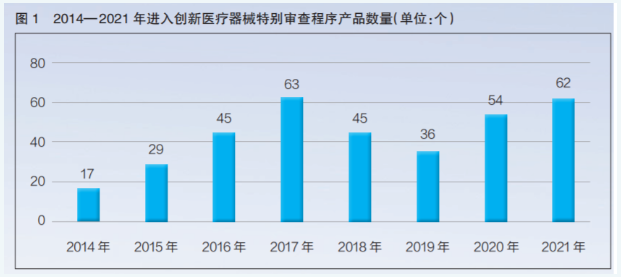
2017年进入特别审批程序产品数量最多
2017 年有63个医疗器械进入特别审批程序,是数量最多的一年;2018年、2019年数量出现下降,有行业媒体认为,这是因为2018年末新修订《创新医疗器械特别审查程序》正式实施,新规对“创新”要求更为严格;2020年以后,随着新修订《创新医疗器械特别审查程序》在各地的充分落地,医疗器械企业创新热情高涨,加大研发力度,进入创新医疗器械特别审查程序的产品数量呈现快速增长态势,2021年共有62个产品进入特别审查程序,与2017年基本持平(详见图1)。
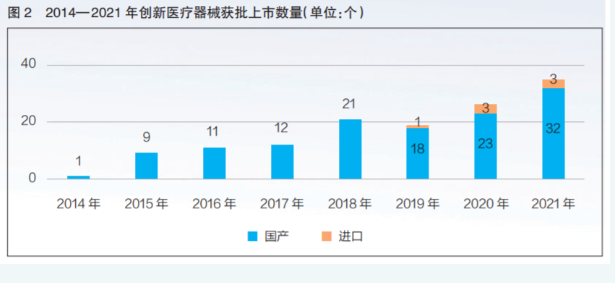
截至2021年12月31日,在进入创新医疗器械特别审查程序的351个产品中,国家药监部门已批准113家企业的134个产品上市。其中,国产产品127个,进口产品7个(详见图2)。
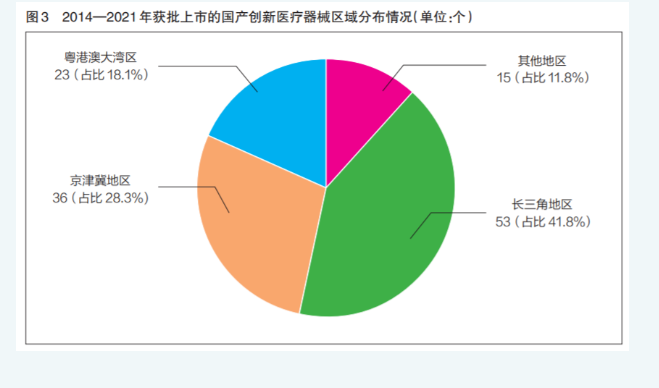
三大地区创新成效凸显
分析2014年至2021年获批上市的国产创新医疗器械,按照企业所在地区分类,长三角地区占比最高,通过审批数量合计53个,占历年审批总量的41.8%;京津冀地区位列第二,合计36个,占比28.3%;粤港澳大湾区排名第三,合计23个,占比18.1%(详见图3)。
据众成医械统计,截至2021年底,长三角地区、京津冀地区、粤港澳大湾区医疗器械生产企业数量分别为7912家、3561家、4774家。
从高新技术企业数量来看,长三角地区拔得头筹,共计2199家。从高新技术企业与医疗器械生产企业数量占比来看,粤港澳大湾区占比最高,达32.7%,即每3家医疗器械生产企业中就有一家为高新技术企业。
据众成医械统计,京津冀地区和粤港澳大湾区医疗器械上市企业研发强度(研发费用占营业收入的比例)均超过7.60%,高于国内医疗器械上市企业平均水平(6.5%);长三角地区医疗器械企业研发投入占比相对较低,为5.1%。
北上广苏企业创新能力突出
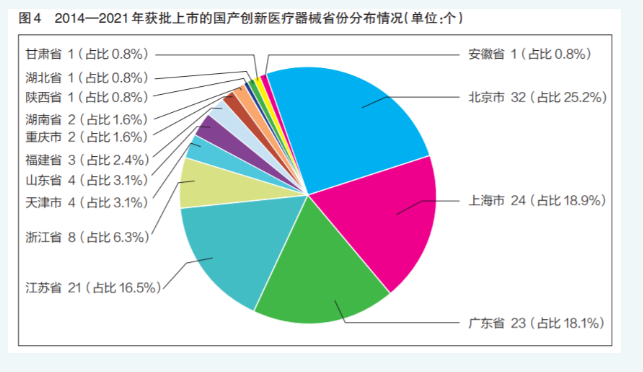
127个获批上市的国产创新医疗器械产品涉及14个省(区、市)的106家医疗器械企业。北京市、上海市、广东省、江苏省企业产品通过审批数量明显高于其他省份,其中北京市共有32个创新医疗器械获批上市,占比25.2%,位列第一(详见图4)。
在106家企业中,共有15家企业拥有两个及以上创新医疗器械通过审批。其中,北京品驰医疗设备有限公司、上海联影医疗科技有限公司各有4个创新医疗器械获批上市,数量多于其他企业。从企业地域分布来看,北京市、上海市各有4家企业,并列首位;江苏省和广东省各3家,福建省1家。
2021年创新产品上市数量增加
增幅同比超过34.6%
2021年,共有62个产品进入创新医疗器械特别审查程序,相较2020年的54个有所增加。其中,35个创新医疗器械获批上市(含3个进口产品),这一数字在2020年为26个(含3个进口产品),增幅同比超过34.6%。
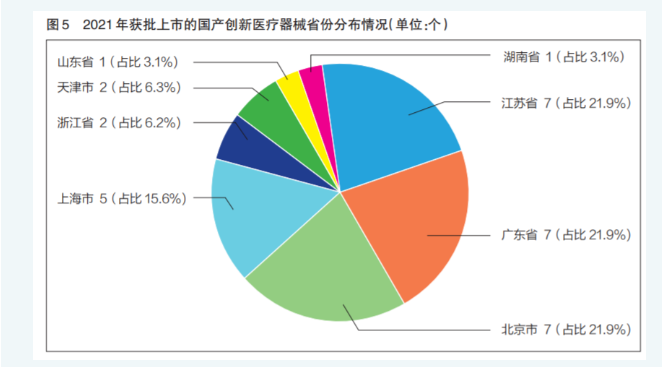
2021年,北京市、江苏省、广东省均有7个创新医疗器械获批上市,数量在全国并列第一。三省份获批上市的创新医疗器械总量接近全国总量的三分之二(详见图5)。
心血管领域成研发热门
据医疗器械创新网,从治疗领域来看,2021年获批上市的35个创新医疗器械中,心血管领域产品超过30%。数据显示,在全球医疗器械市场中,心血管领域是非常重要的细分领域,其市场规模预计将从2017年的526亿美元增长至2024年的796亿美元,市场份额相应从11.6%增长至12.2%。近年来,心血管领域成为国内医疗器械企业研发热门领域,细分产品心血管支架是高端医疗器械进口替代进展较快的细分领域之一。
除了心血管领域,眼科、骨科、体外诊断试剂都有相关创新产品获批上市。这些创新性强、技术含量高、临床需求迫切的创新产品的上市,填补了相关领域的空白,更好满足了群众的健康需求。
政策红利逐步释放
国家层面鼓励医疗器械技术创新
创新医疗器械产业的蓬勃发展离不开国家政策的大力支持。近年来,国家层面发布了一系列政策文件,大力支持医疗器械技术创新,促进产业结构调整,助力产业升级。
2014年2月,国家药监部门发布《创新医疗器械特别审批程序(试行)》,针对具有我国发明专利、技术上具有国内首创、国际领先水平,并且具有显著临床应用价值的医疗器械设置特别审批通道;2018年11月,修订发布《创新医疗器械特别审查程序》,完善适用情形,细化申请流程,提升创新审查的实效性,完善审查方式和通知形式,并明确对创新医疗器械的许可事项变更优先办理。
近年来,国家药监局持续推进医疗器械注册技术审查指导原则的制修订工作,努力提高注册申报资料质量,提升审评效率。根据国家药监局统计,截至2021年5月底,已发布医疗器械注册技术审查指导原则399项,涵盖有源医疗器械、无源医疗器械、体外诊断试剂,涉及真实世界数据用于医疗器械临床评价、医疗器械安全和性能的基本原则、医疗器械通用名称命名、医疗器械附条件批准上市等方面。
据国家药监局统计,进入创新医疗器械特别审查程序的产品,获得注册证的时间比同类其他产品平均减少83天。此举显著增加了产品竞争力,有利于抢占市场先机。
监管部门对于创新医疗器械的审批标准非常严格,从申请门槛及申报条件来看,创新医疗器械要求产品已经基本定型,并在技术上处于国际领先水平,显然更具竞争力。近年来,国家大力支持自主研发,支持“专精特新”企业产品进入特别审批通道,给具有创新精神和能力的医疗器械企业带来利好。
三大地区迎来鼓励政策
近年来,长三角地区、京津冀地区、粤港澳大湾区密集迎来国家鼓励医疗器械产业创新发展相关政策,政策驱动下,上述地区已成为我国医疗器械产业聚集地。
2016年6月,国家发展和改革委员会、住房和城乡建设部联合印发的《长江三角洲城市群发展规划》提出,要依托优势创新链培育新兴产业,其中包括医疗器械产业。2019年12月,中共中央、国务院印发的《长江三角洲区域一体化发展规划纲要》明确,支持苏北、浙西南、皖北和皖西大别山革命老区重点发展大健康、医药产业等特色产业及配套产业。
2018年11月,中共中央、国务院印发的《关于建立更加有效的区域协调发展新机制的意见》提出,以疏解北京非首都功能为“牛鼻子”推动京津冀协同发展,调整区域经济结构和空间结构,推动河北雄安新区和北京城市副中心建设。根据《河北雄安新区规划纲要》,雄安新区将培育高性能医疗器械产业,实施医疗器械创新发展工程等,建设世界一流的生物技术与生命科学创新示范中心、高端医疗和健康服务中心、生物产业基地。
2019年2月,中共中央、国务院印发的《粤港澳大湾区发展规划纲要》提出要塑造健康湾区。医疗器械产业是大健康产业的重要组成部分,2020年11月,国家市场监督管理总局、国家药监局等八部门联合发布《粤港澳大湾区药品医疗器械监管创新发展工作方案》,提出创新药品医疗器械监管方式,整合监管资源,促进医药产业在粤港澳大湾区融合发展,塑造具有创新活力的健康湾区。
2020年12月,国家药监局在长三角、大湾区分别设立医疗器械技术审评检查分中心,高效推进当地审评检查工作,服务支持医疗器械产业高质量发展,更好支持企业研发创新。
随着政策推动及企业创新能力的提升,我国拥有自主知识产权的创新医疗器械将加速涌现,国产医疗器械在市场中的占比也将逐步提高,更好满足临床需求。
相关推荐
CIO提供以下相关文库下载、合规服务以及线上培训课程学习
热门推荐
最新推荐

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

医疗机构制剂注册备案
1.CIO为医疗机构配制制剂提供一站式合规服务。 2.帮助医疗机构取得医疗机构制剂注册批件。 3.价格合理,服务更省心。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

医疗器械互联网信息服务备案
自2025年1月20日起,国家药监局将“药品、医疗器械互联网信息服务审批”改为备案管理。我们为自建网站或平台销售医疗器械的企业提供专业的医疗器械互联网信息服务备案咨询服务,帮助企业高效完成备案。

药品互联网信息服务备案
自2025年1月20日起,药品和医疗器械互联网信息服务审批不再需要前置审批,转而实行备案管理。我们致力于为药企提供高效、专业的药品互联网信息服务备案服务,帮助客户顺利开展网络销售业务。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。







