基本信息
1. 办理部门:国家药品监督管理局
2. 办理方式:网上办理,窗口办理
3. 办理地点:(1)北京市朝阳区建国路128号;(二)北京市西城区宣武门西大街28号大成广场3门一层
4. 药监咨询:010-85242306(周二、周四)或010-88331793(周一、周二) CIO咨询:400-003-0818
受理条件
申请事项属于本行政机关职权范围,申请材料齐全、符合法定形式,或者申请人按照本行政机关的要求提交全部补正申请材料的,受理行政许可申请。申请人应当为能够承担相应法律责任的企业或者药品研制机构等。境外申请人应当指定中国境内的企业法人办理相关药品注册事项。
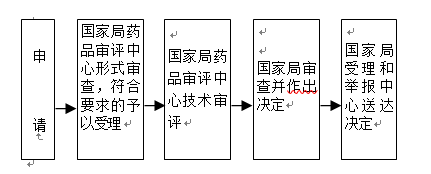
办理流程
流程文字说明
1.受理:受理人员对申请材料进行形式审查。申请事项依法不需要取得行政许可的,即时告知申请人不受理;申请事项依法不属于本行政机关职权范围的,即时作出不予受理的决定,并告知申请人向有关行政机关申请;申请材料存在可以当场更正的错误的,允许申请人当场更正;申请材料不齐全或者不符合法定形式的,当场或者在五日内一次告知申请人需要补正的全部内容,逾期不告知的,自收到申请材料之日起即为受理;申请事项属于本行政机关职权范围,申请材料齐全、符合法定形式,或者申请人按照本行政机关的要求提交全部补正申请材料的,受理行政许可申请。
2.应在200日内完成技术审评,其中优先审评审批程序的审评时限为130日,临床急需境外已上市罕见病用药优先审评审批的审评时限为70日。在技术审评过程中需要申请人补充新的技术资料的,申请人应当在80日内按照通知要求一次性完成补充资料;不需要补充新的技术资料,仅需申请人对原申报资料进行解释说明的,申请人应在5日内按要求提交相关解释说明。进入特殊审批程序的,按照特殊审批程序的要求办理。
3.行政审批决定应当在20日内作出;根据《药品上市许可优先审评审批工作程序(试行)》,对于纳入优先审评审批程序的品种,行政审批决定应当在10日内作出。
4.送达 自行政许可决定作出之日起10日内,NMPA受理和举报中心将行政许可决定送达申请人。
申请材料
1.注册申请表。
依据《总局关于发布药品注册受理审查指南(试行)的通告》(2017年第194号通告)附件5要求,需提交药品注册申请表四份,至少一份为原件。
2.小型微型企业收费优惠申请表。
依据《总局关于发布药品注册受理审查指南(试行)的通告》(2017年第194号通告)附件5要求,需提交小型微型企业收费优惠申请表(如适用)四份,至少一份为原件。
3.申报资料自查表。
依据《总局关于发布药品注册受理审查指南(试行)的通告》(2017年第194号通告)附件5要求,需提交申报资料自查表四份,至少一份为原件。
4.申报资料。
依据《总局关于发布药品注册受理审查指南(试行)的通告》(2017年第194号通告)附件5要求,根据总局《药品注册管理办法》附件1要求提供符合要求的申报资料。申报资料的格式、目录及项目编号不能改变,对应项目无相关信息或研究资料,项目编号和名称也应保留,可在项下注明“无相关研究内容”或“不适用”。完成临床试验后申请新药生产,一般应报送资料项目1—33,以及其他变更和补充申请的资料,并详细说明变更的理由和依据。应提交临床试验数据库电子文件。
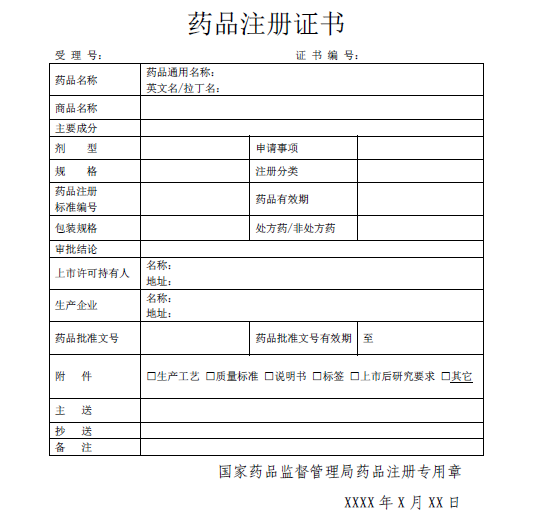
结果样本
常见问题
问题1:申报资料中的外文资料是否全部翻译为中文?
答: 根据《药品注册管理办法》,全部申报资料应当使用中文并附原文,其他文种的资料可附后作为参考。中文译文应当与原文一致。
本办事指南摘自药监局官网,如有变动,以官方发布为准。