基本信息
1、办理部门:江苏省药品监督管理局
2、办理方式:窗口办理,网上办理,快递申请
3、办理地点:南京市建邺区汉中门大街145号江苏省政务服务中心省药监局窗口
4、咨询电话: 12315 CIO咨询:400-003-0818
受理条件
《中华人民共和国行政许可法》第三十二条第五项: 申请事项属于本行政机关职权范围,申请材料齐全、符合法定形式,或者申请人按照本行政机关的要求提交全部补正申请材料的,应当受理行政许可申请。
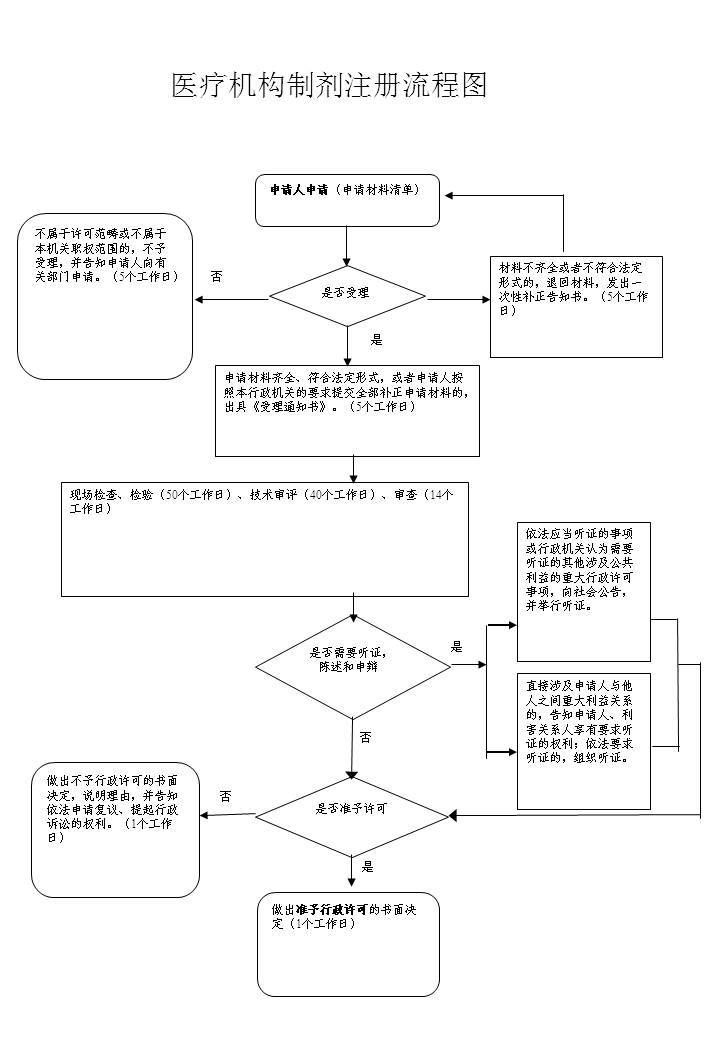
办理流程
流程文字说明
1、审查决定(时限:100个工作日)
办理结果:医疗机构制剂注册批件。
申请材料
1、制剂注册申请表;>>申请表
2、制剂名称及命名依据;
3、立题目的以及该品种的市场供应情况;
4、证明性文件【(1)《医疗机构执业许可证》正、副本复印件、《医疗机构制剂许可证》正、副本复印件;(2)所申报的制剂市场上没有供应的保证;(3)医疗机构制剂或者使用的处方、工艺等的专利情况及其权属状态说明,以及对他人的专利不构成侵权的声明;(4)提供化学原料药的合法来源证明文件,包括:原料药的批准证明性文件、销售发票、检验报告书、药品标准等资料复印件;(5)直接接触制剂的包装材料和容器的注册证书复印件】;
5、标签及说明书设计样稿;
6、处方组成、来源、理论依据以及使用背景情况;
7、配制工艺的研究资料及文献资料;
8、质量研究的试验资料及文献资料;
9、制剂的质量标准草案及起草说明;
10、制剂的稳定性试验资料;
11、样品的自检报告书(样品的自检报告书,是指由医疗机构对制剂进行检验并出具的检验报告书。报送临床试验前资料时应提供连续3批样品的自检报告。未取得《医疗机构制剂许可证》或《医疗机构制剂许可证》无相应制剂剂型的“医院”类别的医疗机构申请医疗机构中药制剂者,应当提供受委托配制单位出具的连续3批制剂样品的自检报告);
12、辅料的来源及质量标准;
13、直接接触制剂的包装材料和容器的选择依据及质量标准;
14、主要药效学试验资料及文献资料;
15、急性毒性试验资料及文献资料;
16、长期毒性试验资料及文献资料;
17、临床试验方案;
18、临床试验总结(报送临床试验总结资料,应同时报送按复核后的质量标准检验的连续3批自检报告书)。
结果样本

常见问题
问题1:根据中医药理论组方,利用传统工艺配制,且有长期使用历史的中药制剂是否可免药理毒理研究、临床试验?
答:根据中医药理论组方,利用传统工艺配制(即制剂配制过程没有使原组方中治疗疾病的物质基础发生变化的),且该处方在本医疗机构具有5年以上(含5年)使用历史和100例以上相对完整的临床病历的中药制剂(由申请人提供该制剂在该医疗机构应用时的处方和有关档案等证明性资料附在资料项3中),可免报资料项13-17。但是,如果有下列情况之一者需报送资料项目14、15:(1)处方组成含有法定标准中标识有毒性及现代毒理学证明有毒性的药材;(2)处方组成含有十八反、十九畏配伍禁忌;(3)处方中的药味用量超过药品标准规定的。
本办事指南摘自药监局官网,如有变动,以官方发布为准。