基本信息
1、办理部门:江苏省药品监督管理局
2、办理方式:网上办理
3、办理地点:南京市建邺区汉中门大街145号江苏省政务服务中心省药监局窗口
4、咨询电话: 12315 CIO咨询:400-003-0818
受理条件
《中华人民共和国行政许可法》第三十二条第五项: 申请事项属于本行政机关职权范围,申请材料齐全、符合法定形式,或者申请人按照本行政机关的要求提交全部补正申请材料的,应当受理行政许可申请。
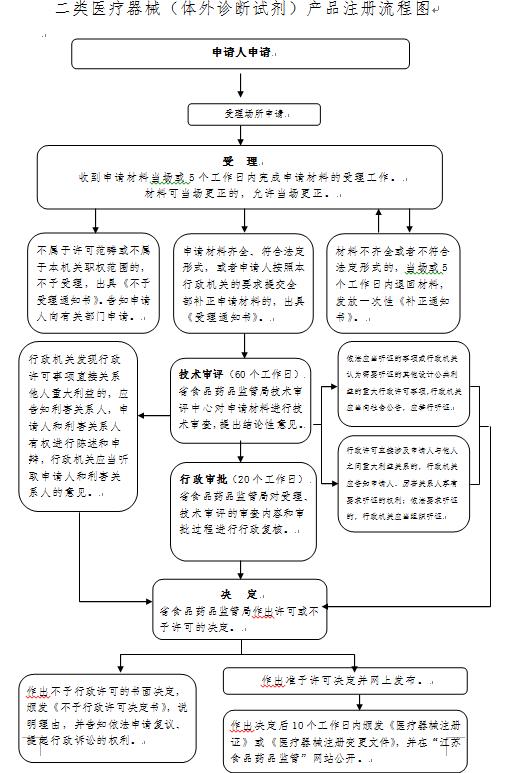
办理流程
流程文字说明
1、受理(时限:5个工作日)
办理结果:在5个工作日内, 对不属于许可范畴或不属于本机关职权范围的,不予受理,并出具《不予受理通知书》;对申请资料不齐全或不符合法定形式的,出具《补正通知书》,一次性告知申请人需要补正的全部内容;对申报资料齐全或已经按照要求提交全部补正申请资料的申请作出受理决定,出具《受理通知书》。
2、审评核查(时限:40个工作日)
办理结果:根据《体外诊断试剂注册与备案管理办法》等有关法规,对申请进行技术审评、核查。
3、审批(时限:10个工作日)
办理结果:根据《体外诊断试剂注册与备案管理办法》等有关法规,对申请材料进行实质内容审查,并做出决定。
4、制证(时限:5个工作日)
办理结果:发放医疗器械注册证(体外诊断试剂)。
申请材料
1、1.监管信息;
2、1.1章节目录;
3、1.2申请表;>>申请表
4、1.3关联文件;
5、1.4申报前与监管机构的联系情况和沟通记录;
6、1.5符合性声明;>>承诺书
7、2.综述资料;
8、2.1章节目录;
9、2.2概述;
10、2.3产品变更情况描述;
11、2.4变更对产品安全性、有效性影响的技术分析;
12、3.非临床资料;
13、3.1章节目录;
14、3.2产品风险管理资料;
15、3.3产品技术要求;
16、3.4产品检验报告;
17、3.5分析性能研究;
18、3.6稳定性研究;
19、3.7阳性判断值或参考区间研究;
20、3.8需说明的资料;
21、4.临床评价资料(需要进行临床评价的第二类体外诊断试剂,注册人应根据具体变更情况,基于变化部分对产品安全性、有效性影响的论述,必要时采用适当的方法进行临床评价并按照以下要求提交资料);
22、4.1章节目录;
23、4.2临床评价资料要求;
24、5.产品说明书;
25、5.1章节目录;
26、5.2产品说明书;
27、6.质量管理体系文件(已注册产品发生前述变更情形的,注册人应当承诺已根据产品变更的具体情况,按照法规要求对已建立的质量管理体系进行相应调整,并随时接受质量管理体系核查。 注册人提出变更的具体原因或目的涉及原材料、生产工艺变化的,应当针对变化部分进行质量管理体系核查;除此以外的变化,一般不需进行质量管理体系核查。 需要进行质量管理体系核查的,应当按照要求提交本部分资料);
28、6.1综述;
29、6.2章节目录;
30、6.3生产制造信息;
31、6.4质量管理体系程序;
32、6.5管理职责程序;
33、6.6资源管理程序;
34、6.7产品实现程序;
35、6.8质量管理体系的测量、分析和改进程序;
36、6.9需说明的质量体系程序信息;
37、6.10质量管理体系核查文件;>>质量管理体系核查文件
38、7.需要说明的申请资料(委托生产适用);
39、7.1关联文件(委托生产适用);
40、7.2产品说明书(委托生产适用);
41、7.3质量管理体系文件(委托生产适用)。
结果样本

常见问题
问题1:什么情况下需要申请体外诊断试剂注册证变更?
答:已注册的第二类、第三类医疗器械产品,其设计、原材料、生产工艺、使用范围、使用方法等发生实质性变化,有可能影响该医疗器械安全、有效的,注册人应向原注册部门申请办理变更注册手续。
本办事指南摘自药监局官网,如有变动,以官方发布为准。