基本信息
1、办理部门:河北省药品监督管理局
2、办理方式:网上办理
3、办理地点:河北省石家庄市新华区石清路9号省政务服务大厅1号楼二层综合受理区综合受理窗口
4、咨询电话:0311-66635315 CIO咨询:400-003-0818。
受理条件
《体外诊断试剂注册与备案管理办法》(国家市场监督管理总局令第48号) 第十四条 体外诊断试剂注册、备案,应当遵守相关法律、法规、规章、强制性标准,遵循体外诊断试剂安全和性能基本原则,参照相关技术指导原则,证明注册、备案的体外诊断试剂安全、有效、质量可控,保证信息真实、准确、完整和可追溯。
第十五条 申请人、备案人应当为能够承担相应法律责任的企业或者研制机构。 境外申请人、备案人应当指定中国境内的企业法人作为代理人,办理相关体外诊断试剂注册、备案事项。代理人应当依法协助注册人、备案人履行《医疗器械监督管理条例》第二十条第一款规定的义务,并协助境外注册人、备案人落实相应法律责任。
第十六条 申请人、备案人应当建立与产品研制、生产有关的质量管理体系,并保持有效运行。
第十七条 办理体外诊断试剂注册、备案事项的人员应当具有相关专业知识,熟悉体外诊断试剂注册、备案管理的法律、法规、规章和注册管理相关规定。
第十八条 申请注册或者进行备案,应当按照国家药品监督管理局有关注册、备案的要求提交相关资料,申请人、备案人对资料的真实性负责。 注册、备案资料应当使用中文。根据外文资料翻译的,应当同时提供原文。引用未公开发表的文献资料时,应当提供资料权利人许可使用的文件。
第十九条 申请进口体外诊断试剂注册、办理进口体外诊断试剂备案,应当提交申请人、备案人注册地或者生产地所在国家(地区)主管部门准许上市销售的证明文件。 申请人、备案人注册地或者生产地所在国家(地区)未将该产品作为医疗器械管理的,申请人、备案人需提供相关文件,包括注册地或者生产地所在国家(地区)准备该产品上市销售的证明文件。 未在申请人、备案人注册地或者生产地所在国家(地区)上市的按照创新产品注册程序审批的体外诊断试剂,不需提交相关文件。
第二十条 体外诊断试剂应当符合适用的强制性标准。产品结构特征、技术原理、预期用途、使用方式等与强制性标准的适用范围不一致的,申请人、备案人应当提出不适用强制性标准的说明,并提供相关资料。 没有强制性标准的,鼓励申请人、备案人采用推荐性标准。
第二十一条 体外诊断试剂注册、备案工作应当遵循体外诊断试剂分类规则和分类目录的有关要求。
办理流程
流程文字说明
法定办理时限:30个工作日;承诺办理时限:15个工作日
1、受理(时限:5个工作日)
2、特殊环节(时限:60个工作日,不纳入计时)
3、特殊环节(时限:30个工作日,不纳入计时)
4、行政审批(时限:14个工作日)
5、制证、送达(时限:10个工作日,不纳入计时)
>>委托办理咨询 医疗器械注册证办理服务
申请材料
有源、无源医疗器械首次注册:
1、监管信息;
2、综述资料;
3、非临床资料;
4、临床评价资料;
5、产品说明书和标签样稿;
6、质量管理体系文件。
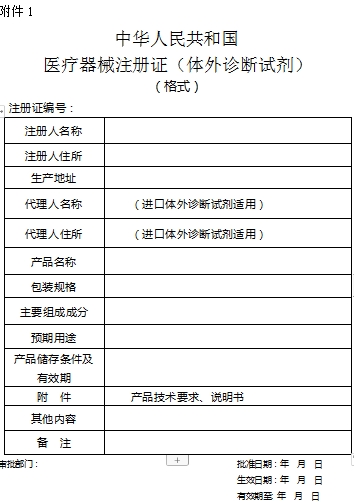
结果样本
常见问题
问题1:办理该项业务需要哪些材料?
答:具体需要哪些材料在服务指南中有详细的说明。
本办事指南摘自药监局官网,如有变动,以官方发布为准。





















