基本信息
1、办理部门:北京市药品监督管理局
2、办理方式:窗口办理,网上办理,快递申请
3、办理地点:
北京市政务服务中心——北京市丰台区西三环南路1号(六里桥西南角)(1-3层综合窗口)
北京城市副中心政务服务中心——北京市通州区新华东街48号二区(东南角)(综合窗口)
4、咨询电话: (010)89150290 CIO咨询:400-003-0818
受理条件
1.申请材料应真实、完整、清晰、整洁,逐份加盖企业公章,要求签字的须签字。 2.注册人填报的表格和编写的申请材料均应为A4规格纸张,政府及其他机构出具的文件按原件尺寸提供。 3.凡申请材料应提交复印件的,复印件应清晰,并应在复印件上注明日期,加盖企业公章。 注:如公示期间内医疗器械注册申请直接涉及注册人与他人之间重大利益关系的,重大利益相关人依照法律、法规以及国家食品药品监督管理总局的其他规定享有申请听证的权利(注:如需要依法听证的,应当将所需时间书面告知注册人,听证所需时间不计算在审批时限内)。 3.对注册人提交的申请材料不齐全或者不符合形式审查要求的,受理人员应当当场一次告知注册人补正有关材料,填写《补正材料通知书》,注明已具备和需要补正的内容。受理人员不能当场告知注册人需要补正的内容的,应当填写《接收材料凭证》交与注册人。受理人员交由移送人员于当日将申请材料转医疗器械监管处,医疗器械监管处接收人员接收材料后,与移送人员在网上填写《行政许可移送表(一)》上部,使用电子签章。医疗器械监管处审核人员审查申请材料,填写《补正材料通知书》,于 3日内将《补正材料通知书》返至受理人员,双方网上填写《行政许可移送表(一)》使用电子签章;受理人员在收到《补正材料通知书》的次日告知注册人补正有关材料,网上填写《行政许可移送表(一)》下部补正告知时间,使用电子签章、并打印归档。 4.对申请事项不属于本部门职权范围或该申请事项不需行政许可,不予受理,填写《不予受理通知书》。 5.《受理通知书》、《补正材料通知书》、《不予受理通知书》应当加盖北京市药品监督管理局行政许可专用章,注明日期。 6.网上填写《行政许可移送表(二)》,使用电子签章。
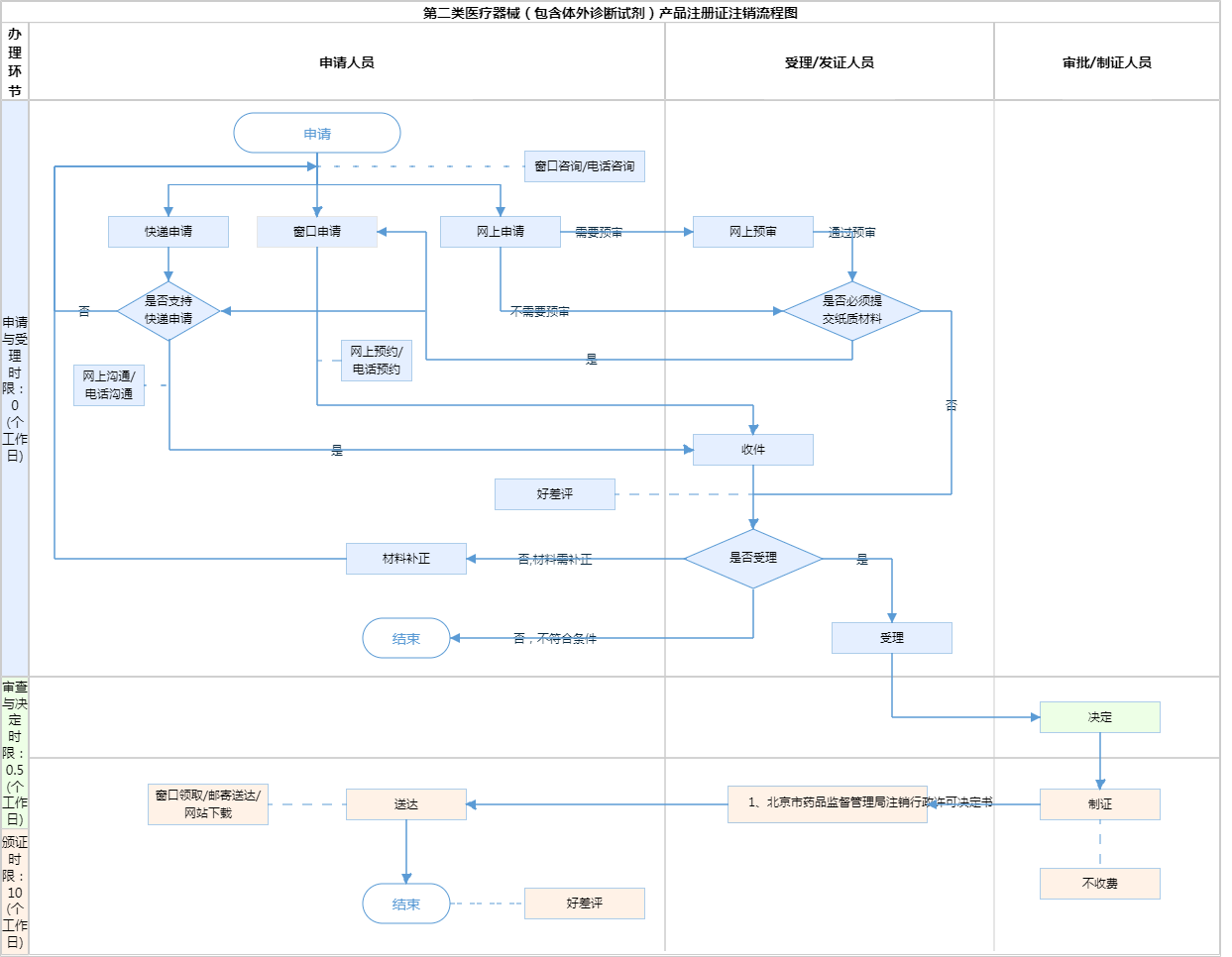
办理流程
流程文字说明
1、受理(时限:0个工作日)
办理结果:能当场受理或者通过当场补正达到受理条件的,直接进入受理步骤,当场出具受理通知书。
2、决定(时限:0.5个工作日)
办理结果:符合要求的,作出行政许可决定;不符合要求的,作出不予行政许可决定。
3、发证(时限:10个工作日)
办理结果:北京市药品监督管理局注销行政许可决定书。
申请材料
1、北京市依申请政务服务事项告知承诺书;
2、第二类医疗器械(包含体外诊断试剂)产品注册证注销申请表;>>申请表
3、营业执照(副本)或事业单位法人证书(副本);
4、医疗器械注册证书及其附件;
5、历次医疗器械注册变更文件及其附件;
6、授权委托书。
结果样本

常见问题
问题1:医疗器械产品注册证有效期?
答:5年。
本办事指南摘自药监局官网,如有变动,以官方发布为准。