基本信息
1、办理部门:河北省药品监督管理局
2、办理方式:网上办理
3、办理地点:河北省石家庄市新华区石清路9号省政务服务大厅1号楼
4、咨询电话:0311-66635315,12345政务服务热线(转省级热线) CIO咨询:400-003-0818
受理条件
《关于发布创新医疗器械特别审查程序的公告》(2018年第83号)
创新医疗器械特别审查程序 第五条:境内申请人应当向其所在地的省级药品监督管理部门提出创新医疗器械特别审查申请。省级药品监督管理部门对申报项目是否符合本程序第二条要求进行初审,并于20个工作日内出具初审意见。经初审不符合第二条要求的,省级药品监督管理部门应当告知申请人;符合第二条要求的,省级药品监督管理部门将申报资料和初审意见一并报送国家药品监督管理局行政事项受理服务和投诉举报中心(以下简称受理和举报中心)。
境外申请人应当向国家药品监督管理局提出创新医疗器械特别审查申请。
同时符合下列情形的医疗器械审查,适用于本程序:
(一)申请人经过其技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过授让取得在中国发明专利权或者使用权;或者核心技术发明专利的申请已由国务院专利行政部门公开。
(二)产品主要工作原理/作用机理为国内首创,产品性能或安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显著的临床应用价值。
(三)申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
办理流程
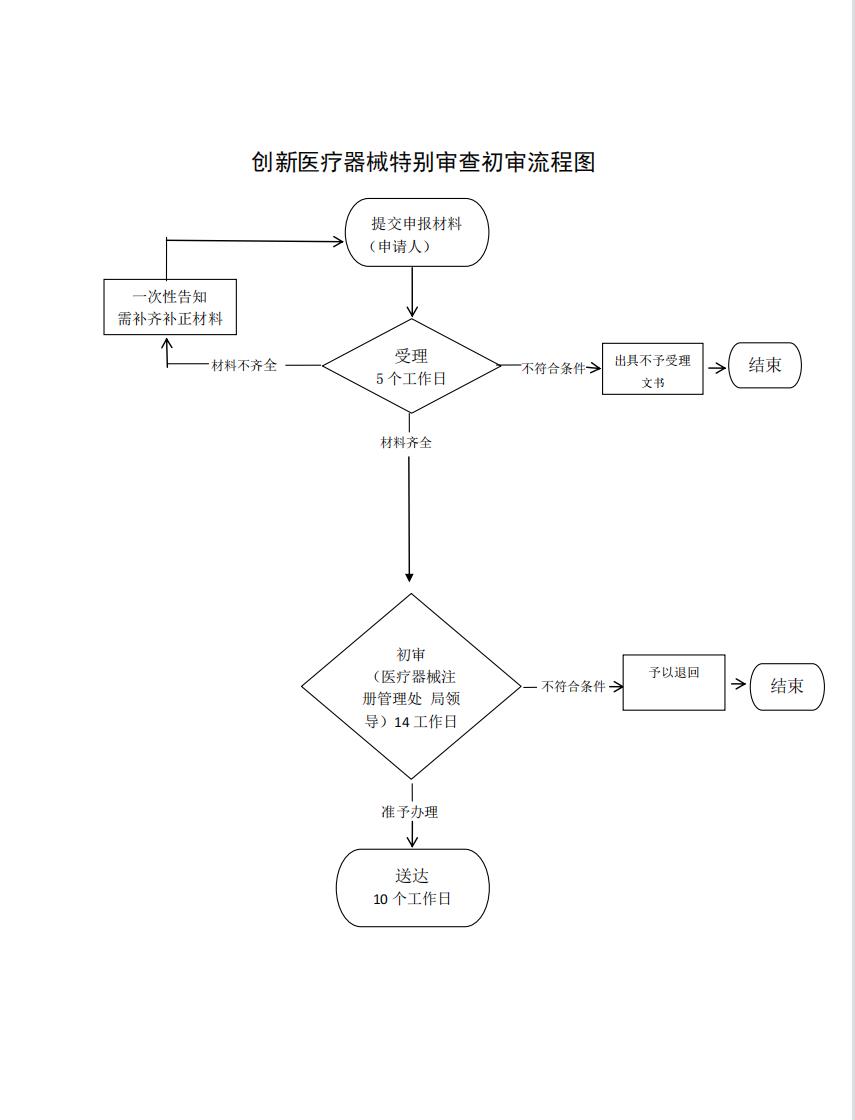
流程文字说明
法定办理时限:20个工作日;承诺办理时限:14个工作日
1、受理(时限:5个工作日,不纳入计时)
2、初审(时限:14个工作日)
3、送达(时限:10个工作日,不纳入计时)
申请材料
1、申请人企业法人资格证明文件;
2、产品知识产权情况及证明材料;
3、产品研发过程及结果的综述;
4、产品技术文件;
5、产品创新的证明性文件;
6、产品安全风险管理报告;
7、产品说明书(样稿);
8、证明产品符合本程序第二条的资料;
9、所提交资料真实性的自我保证声明。
结果样本
暂无
常见问题
问题1:办理该项业务需要哪些材料?
答:具体需要哪些材料在服务指南中有详细的说明。
本办事指南摘自药监局官网,如有变动,以官方发布为准。





















