基本信息
1、办理部门:国家药品监督管理局
2、办理方式:窗口办理,网上办理,快递申请
3、办理地点:北京市丰台区南四环西路188号12区29号楼
4、药监咨询:010-53815833 CIO咨询:400-003-0818
受理条件
申请事项属于本行政机关职权范围,申请材料齐全、符合法定形式,或者申请人按照本行政机关的要求提交全部补正申请材料的,受理行政许可申请。
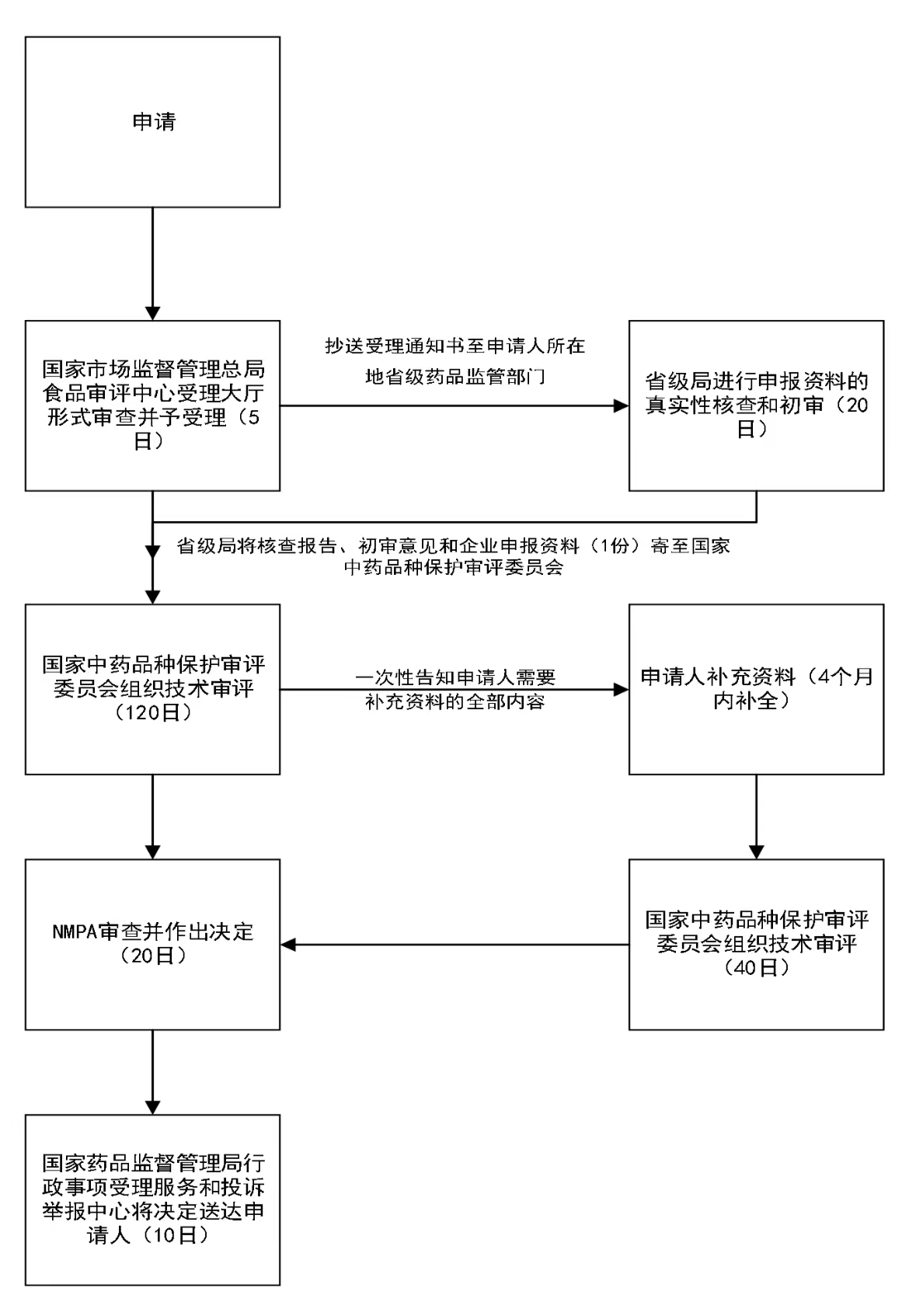
办理流程
流程文字说明
法定办结时限:20个工作日;承诺办结时限:5个工作日
1、受理;
2、初审(必要时组织现场检查);
3、技术评审(国家中药品种保护审评委员会组织专家评审);
4、行政许可决定;
5、送达。
申请材料
1、《中药品种保护申请表》。>>中药品种保护申请表
2、证明性文件:初次保护申请企业应提供其为原研企业的证明资料;现行国家标准、说明书和标签实样;专利权属状态说明书及证明文件。
3、申请保护依据与理由综述。
4、医学相关资料(批准上市前研究资料、批准上市后研究资料)。
5、药学相关资料(批准上市前研究资料、批准上市后研究资料)。
6、药理毒理相关资料(批准上市前研究资料、批准上市后研究资料)。
7、拟改进提高计划与实施方案。
结果样本



常见问题
问题1:中药新药使用原有的注册资料申报初次保护需要注意哪些问题?
答:需注意原注册资料能否说明申报品种具有临床疗效优势。若现有的临床试验资料基本规范完整,仅能说明临床用药安全有效的,还需进一步提供资料证明其临床疗效优势。
企业可再进行100对的临床观察;多适应症的,可结合临床实际应用情况重点观察某一个主要适应症,如观察多个适应症,每个适应症要求不少于60对,以探讨申报品种是否具有疗效优势。
问题2:简单改剂型品种已与原剂型进行了临床对照试验,申请初次保护是否还需要另行开展临床试验?
答:需要另行开展临床试验。与原剂型对照的临床试验,仅能用于证明改剂型的合理性,申请初次保护仍要求开展与同类药比较的临床试验以证明其临床疗效优势。
问题3:初次保护申请开展上市后临床观察需遵循什么原则?
答:建议结合申报品种的实际临床应用情况,参照《药品注册管理办法》Ⅲ期临床研究相关要求,进行试验设计,选择合适的对照药进行临床比较观察,疾病(症状、证候)的诊断和疗效评价需采用现行公认的技术标准。
问题4:独家生产的品种法定质量标准欠完善,申报初次保护应注意哪些问题?
答:①首先应先行提高质量标准,并经省级药检所复核认可;②其次企业还要将提高标准纳为企业内控质量标准,在生产过程中按GMP要求严格执行;③申报资料中应有企业按照内控标准进行产品质量控制的有关资料。
本办事指南摘自药监局官网,如有变动,以官方发布为准。