基本信息
1、办理部门:云南省药品监督管理局
2、办理方式:窗口办理、网上办理
3、办理地点:云南省昆明市高新区科发路616号云南省药品监督管理局一楼行政受理4号窗口。市内可乘85路、267路公交车到科发路口科高路站;116路、83路公车到科发路口(海源北路)站下车即到
4、咨询电话:0871-68571817/68571936/68571961 CIO咨询:400-003-0818
受理条件
1.本备案事项适用于云南省行政区域内第二、三类医疗器械进行临床试验的(除需进行临床试验审批的)备案申请。 2.符合下列条件之一的单位可以提出申请: 云南省行政区域内的注册申请人。 3.具有下列情形之一的,不予受理: (1)申报资料存在可以当场更正的错误的,应当允许申请人当场更正。 (2)申报资料不齐全或者不符合形式审查要求的,应当在5个工作日内一次告知申请人需要补正的全部内容,逾期不告知的,自收到申报资料之日起即为受理。 (3)申请事项不属于本部门职权范围的,应当即时告知申请人不予受理。
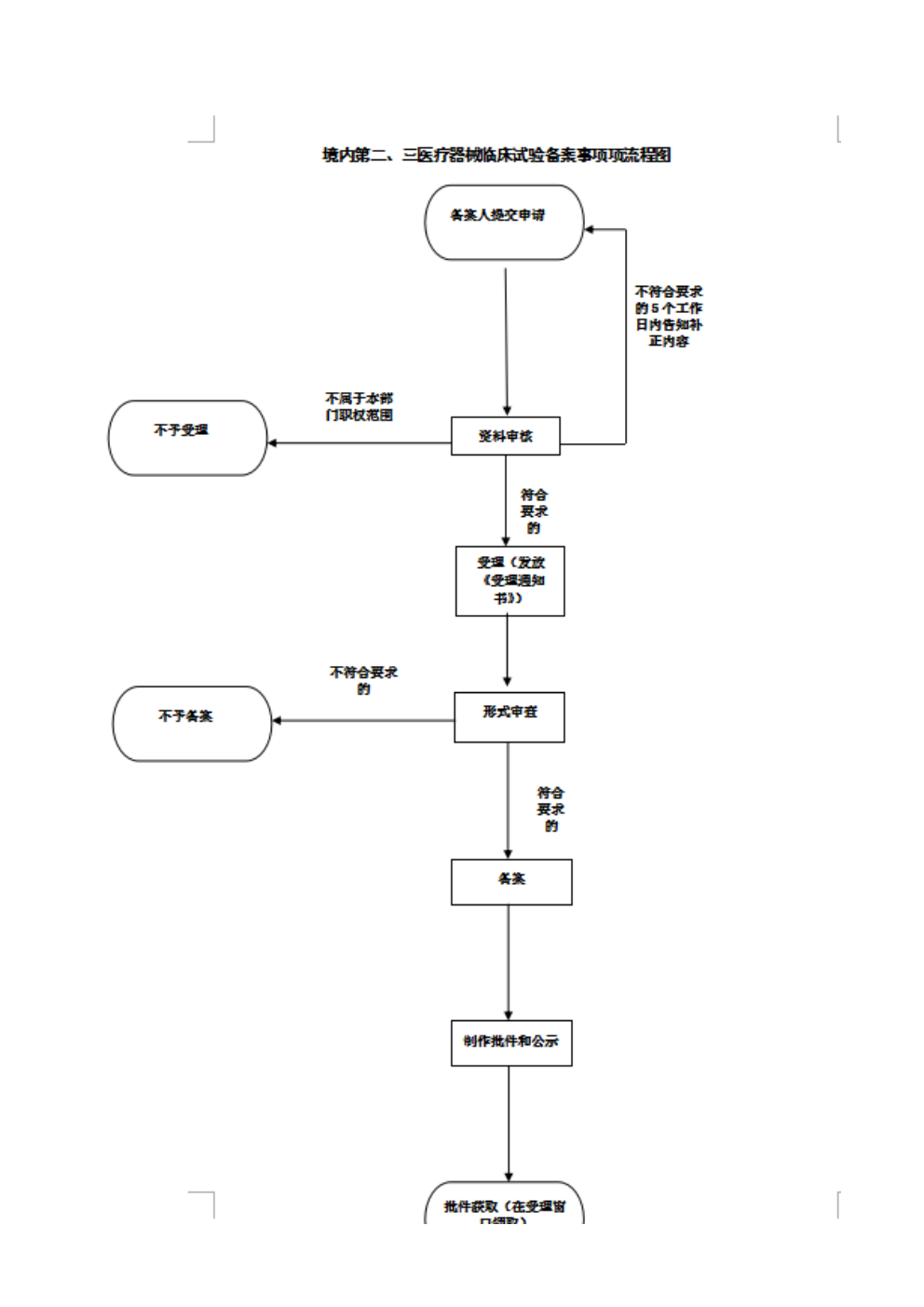
办理流程
流程文字说明
法定办理时限:1个工作日;承诺办理时限:1个工作日
1、申请
2、受理(即时办理)
3、审查(即时办理)
4、决定(即时办理)
5、送达
申请材料
1、境内第二、三类医疗器械临床试验备案事项申请表;
2、营业执照;
3、伦理委员会意见;
4、临床试验协议或合同;
5、医疗器械临床试验批件;
6、符合性声明。
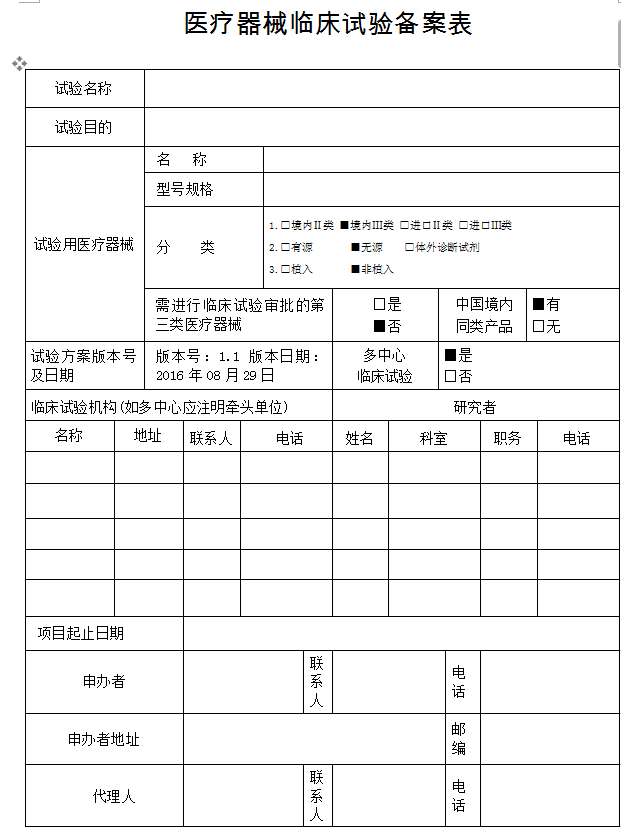
结果样本
常见问题
无
本办事指南摘自药监局官网,如有变动,以官方发布为准。






























