基本信息
1、办理部门:云南省药品监督管理局
2、办理方式:窗口办理、网上办理
3、办理地点:云南省昆明市高新区科发路616号云南省药品监督管理局一楼行政受理1号窗口。市内可乘85路、267路公交车到科发路口科高路站;116路、83路公车到科发路口(海源北路)站下车即到
4、咨询电话:0871-68571817/68571936/68571961 CIO咨询:400-003-0818
受理条件
《药品注册管理办法》第六条省、自治区、直辖市药品监督管理部门负责本行政区域内以下药品注册相关管理工作:(一)境内生产药品再注册申请的受理、审查和审批;(二)药品上市后变更的备案、报告事项管理;(三)组织对药物非临床安全性评价研究机构、药物临床试验机构的日常监管及违法行为的查处;(四)参与国家药品监督管理局组织的药品注册核查、检验等工作;(五)国家药品监督管理局委托实施的药品注册相关事项。第七十九条以下变更,持有人应当在变更实施前,报所在地省、自治区、直辖市药品监督管理部门备案:(一)药品生产过程中的中等变更;(二)药品包装标签内容的变更;(三)药品分包装;(四)国家药品监督管理局规定需要备案的其他变更。
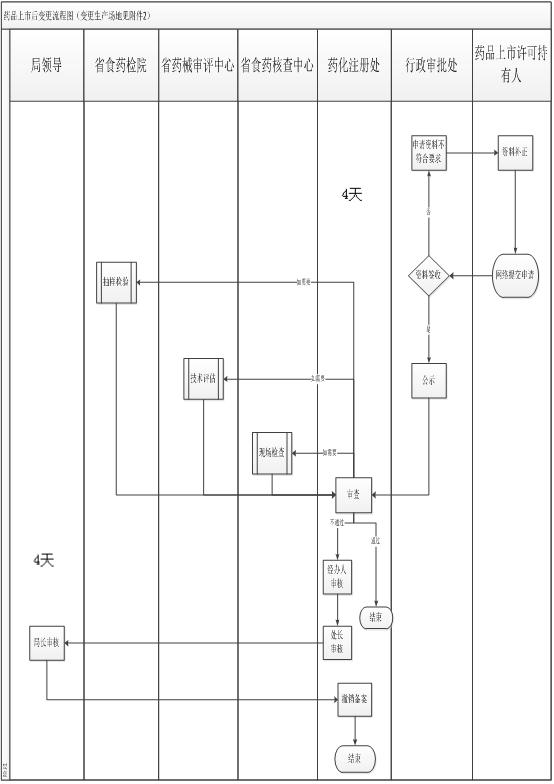
办理流程
流程文字说明
法定办理时限:20个工作日;承诺办理时限:1个工作日
1、申请
2、受理(即时办理)
3、审查(即时办理)
4、决定(即时办理)
5、送达
申请材料
1、药品注册证书及其附件;
2、申请人及生产企业机构合法登记证明文件;
3、申请人及生产企业药品生产许可证及其变更记录页;
4、境内受让方药品生产许可证及其变更记录页;
5、提交转让方和受让方的转让协议;
6、药品分包装合同;
7、毒性药材、处于濒危状态药材的证明文件,或要求进行替代、减去的文件、证明;
8、药材/饮片来源证明文件;
9、药用辅料及药包材合法来源证明文件;
10、药用辅料和药包材使用授权书;
11、委托研究相关证明文件;
12、检查信息;
13、立题目的和依据;
14、修订的药品说明书样稿;
15、修订的药品标签样稿;
16、药学研究资料;
17、药理毒理研究资料;
18、临床研究资料;
19、上市后变更申请表;
20、产品安全性资料综述;
21、说明书的详细修订说明;
22、标签的详细修订说明;
23、申报资料真实性声明。
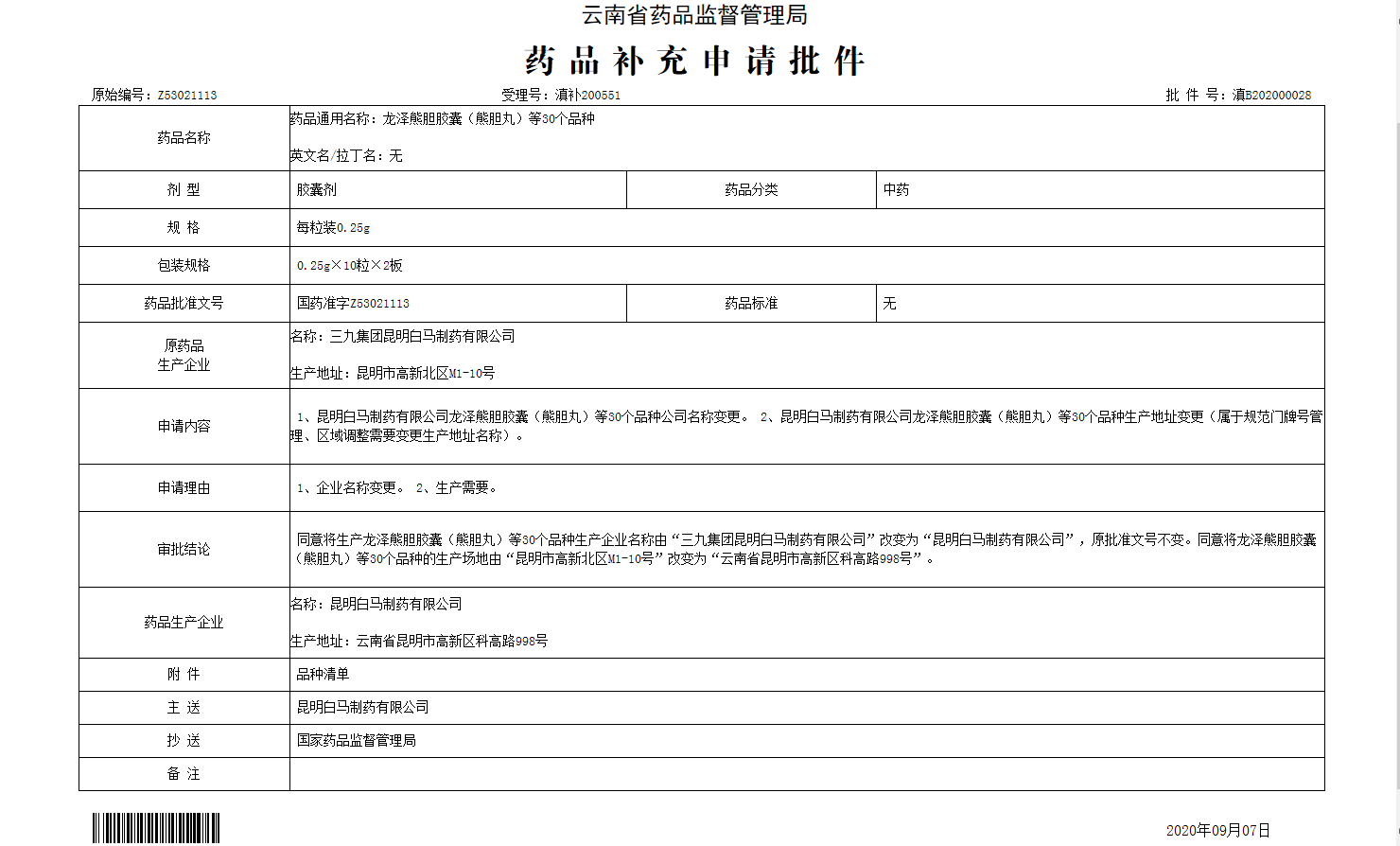
结果样本
常见问题
无
本办事指南摘自药监局官网,如有变动,以官方发布为准。






























