基本信息
1、办理部门:国家药品监督管理局
2、办理方式:网上办理,现场办理,快递申请
3、办理地点:北京市朝阳区建国路128号;北京市西城区宣武门西大街28号大成广场3门一层
4、咨询电话:注册受理咨询:010-85242306(周二、周四)或010-88331793(周一、周二全天) 审评业务咨询:010-85243528(周一、周三、周五) CIO咨询:400-003-0818
受理条件
申请事项属于本行政机关职权范围,申请材料齐全、符合法定形式,或者申请人按照本行政机关的要求提交全部补正申请材料的,受理行政许可申请。 申请人应当为能够承担相应法律责任的企业或者药品研制机构等。境外申请人应当指定中国境内的企业法人办理相关药品注册事项。
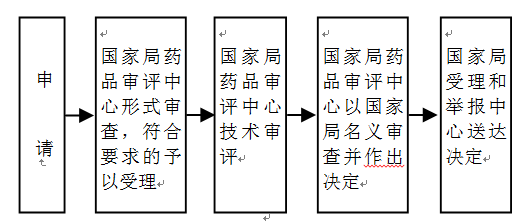
办理流程
流程文字说明
法定办结时限:20个工作日;承诺办结时限:5个工作日
1、受理;
2、技术审评;
3、注册核查(审评过程中基于风险启动);
4、注册检验(审评过程中基于风险启动);
5、行政许可决定;
6、送达。
申请材料
1、(一)已上市中药变更事项: 1.药品注册证书及其附件的复印件;
2、(一)已上市中药变更事项:2.证明性文件;
3、(一)已上市中药变更事项:3.检查检验相关信息;
4、(一)已上市中药变更事项:4.修订的药品质量标准、生产工艺信息表、说明书、标签样稿,并附详细修订说明;
5、(一)已上市中药变更事项:5.药学研究资料;
6、(一)已上市中药变更事项:6.药理毒理研究资料;
7、(一)已上市中药变更事项:7.临床研究资料;
8、(一)已上市中药变更事项:8.产品安全性相关资料综述;
9、(二)已上市化学药品、已上市生物制品变更事项: 1.药品批准证明文件及其附件的复印件;
10、(二)已上市化学药品、已上市生物制品变更事项: 2.证明性文件;
11、(二)已上市化学药品、已上市生物制品变更事项:3.检查检验相关信息;
12、(二)已上市化学药品、已上市生物制品变更事项:4.修订的药品质量标准、生产工艺信息表、说明书、标签样稿,并附详细修订说明;
13、(二)已上市化学药品、已上市生物制品变更事项:5.药学研究资料;
14、(二)已上市化学药品、已上市生物制品变更事项:6.药理毒理研究资料;
15、(二)已上市化学药品、已上市生物制品变更事项:7.临床研究资料。
结果样本


常见问题
问题1:受理通知书、补正通知书、缴费通知书等能否按照申请表/登记表中的通讯地址邮寄?
答: 目前,受理通知书等均邮寄到申请表/登记表中的注册地址。如申请人拟按通讯地址或其他地址接收上述资料,请在申请表/登记表的“其他特别申明事项”中予以注明。
本办事指南摘自药监局官网,如有变动,以官方发布为准。