 E邀专家
E邀专家
2025年全国药品生产许可证(B证)核发分析
CIO专家-冰片
一、总体概况
截至2025年8月31日,全国共新核发药品生产许可证 261张。其中,纯B证(药品上市许可持有人委托生产)共计 84张,占比约 32.2%。
从基于 B 证的产品类型分布来看(见图 1),各类产品占比及数量情况如下:
● 化药(Bh):64 张,以 71.91% 的占比占据主导地位,是当前 B 证申请的主要产品类型。
● 中药(Bz):17 张,占比 19.10%,体现出中药领域在 MAH(药品上市许可持有人)制度下稳步发展的态势。
● 生物制品(Bs):7 张,占比 7.97%。由于生物制品研发难度大、生产工艺复杂,技术壁垒较高,因此其 B 证数量相对较少。
● 其他(Bq,如医用氧):1 张,占比 1.12%。这一数据表明 MAH 制度的覆盖范围十分广泛,并非仅局限于常规药品。
注:部分许可证涵盖多种产品类型(例如许可证类型标注为 Bhz,同时涉及化药与中药),因此各产品类型数量加总后可能会大于 B 证总数。
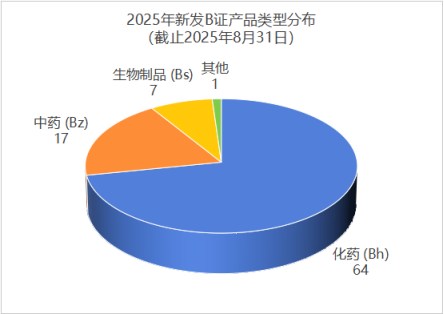
(图1:2025 年新发 B 证产品类型分布(截止 2025 年 8 月 31 日))
二、地域分布分析
全国B证核发呈现明显的地域集聚效应,依据各省份(直辖市/自治区)B 证核发数量,可划分为三个梯队:
表:2025年全国各省(直辖市/自治区)B证核发情况梯队表
梯队 | 省份 | 新发许可证总数 | 纯B证数量 | 特点概述 |
第一梯队(领跑者) (B证 ≥ 5张) | 广东省 | 15 | 10 | 总量最大,企业活跃度高,创新药与仿制药并重 |
上海市 | 11 | 8 | 生物医药绝对高地,8张B证中5张为生物制品(Bs) | |
江苏省 | 25 | 7 | 总许可证数全国第一,产业基础雄厚,化药为主 | |
浙江省 | 14 | 6 | 创新活力强,与上海、江苏形成长三角联动效应 | |
海南省 | 7 | 6 | B证转化率极高(85.7%),政策高地效应显著 | |
第二梯队(积极跟进) (B证 3-4张) | 安徽省 | 27 | 5 | 中药B证特色明显,化药同步发展 |
河南省 | 19 | 5 | ||
北京市 | 4 | 4 | 全部新发证均为B证,聚焦化药创新 | |
福建省 | 6 | 4 | ||
重庆市 | 9 | 4 | 类型多元(化药、中药、生物制品均有) | |
湖南省 | 9 | 4 | ||
陕西省 | 6 | 4 | 中药B证占比较高 | |
第三梯队(初步探索) (B证 1-2张) | 江西省 | 9 | 3 | |
山东省 | 12 | 2 | 与经济大省地位不符,潜力待释放 | |
四川省 | 9 | 2 | ||
山西省 | 5 | 2 | ||
天津市 | 4 | 2 | ||
河北省 | 25 | 1 | 总证数多但B证极少,以中药饮片等传统生产为主 | |
辽宁省 | 4 | 1 | ||
宁夏回族自治区 | 3 | 1 | ||
西藏自治区 | 2 | 1 | ||
贵州省 | 3 | 1 | ||
黑龙江省 | 5 | 1 | ||
青海省 | 2 | 1 | ||
(尚未发证) (B证 = 0张) | 湖北省 | 4 | 0 | 新发许可证均为非B证 |
甘肃省 | 7 | 0 | 新发许可证皆为中药饮片 | |
云南省 | 3 | 0 | ||
新疆维吾尔自治区 | 2 | 0 | ||
吉林省 | 6 | 0 | ||
广西壮族自治区 | 0 | 0 | 暂无新发许可证 |
地域分布显著特点:
1. 双引擎驱动发展:长三角地区(上海、江苏、浙江)与粤港澳大湾区(广东)作为我国医药产业发展的核心区域,在 B 证核发方面表现突出。
2. 生物医药高地优势凸显:上海市在 B 证核发中,生物制品占比极高,充分体现了其在生物医药研发、生产技术、人才储备等方面的雄厚实力,进一步巩固了其在全国生物医药研发和产业化领域的龙头地位,对周边地区及全国生物医药产业发展具有较强的辐射和带动效应。
3. 政策驱动效应显著:海南省凭借博鳌乐城先行区等特殊政策优势,为研发型医药企业提供了良好的发展环境和政策支持,吸引了大量企业前来申请 B 证,使得其 B 证转化率在全国处于领先水平,充分展现了政策对医药产业发展的重要推动作用。
4. 区域发展不平衡问题突出:从全国范围来看,中西部地区(如甘肃、云南、贵州等)和东北地区(如辽宁、黑龙江、吉林等)多数省份在 B 证核发数量上相对较少,反映出这些地区在医药产业创新能力、产业基础、政策配套等方面与东部沿海发达地区存在一定的差距,医药产业发展仍处于起步或探索阶段,区域发展不平衡等问题。
三、 产品类型与趋势分析
(一)化药(Bh):绝对主力
1.发展现状:在 2025 年新发 B 证中,化药 B 证数量为 64 张,占据 B 证总量的四分之三,是当前 MAH 制度实施过程中最为成熟、应用最为广泛的领域。化药产业发展历史悠久,生产工艺成熟,市场需求稳定,因此成为众多医药企业申请 B 证的首选产品类型。
2.未来趋势:从发展趋势来看,化药 B 证申请主要集中在仿制药、改良型新药以及创新药三个方向。随着医药市场竞争的加剧和药品一致性评价工作的持续推进,仿制药质量不断提升,市场集中度逐步提高;改良型新药在原有药品基础上进行改进,能够更好地满足临床需求,具有较高的市场潜力;创新药则是医药企业提升核心竞争力、实现可持续发展的关键领域。在生产模式方面,研发型企业由于自身生产能力有限,委托大型 CRO(合同研究组织)/CMO(合同生产组织)企业进行生产已成为主要模式,这种模式能够充分整合资源,降低企业生产成本,提高生产效率,实现优势互补。
(二)中药(Bz):特色发展
1.发展现状:2025 年新发中药 B 证 17 张,这一数据表明中药领域在 MAH 制度下已成功破冰,打破了以往中药产业发展的传统模式,逐步实现了与现代医药管理制度的融合,呈现出稳步推进的良好发展态势。
2.未来趋势:中药 B 证发展主要呈现两种模式:
(1) 中药新药研发模式:随着人们对中医药重视程度的不断提高和中药现代化进程的加快,中药新药研发成为中药产业发展的重要方向。如陕西牧远药业的 “蓉仙口服液”,便是中药创新发展的典型代表,这类中药新药的研发与上市,为中药产业注入了新的活力,推动了中药产业向创新化、现代化方向发展。
(2) 持有人变更模式:部分中药企业通过持有人变更的方式,实现了经典名方、存量品种批文的流转。例如,广东祥源药业的 “保和丸”、河南亨泽药业的 “磁朱丸” 等,通过这种模式,不仅盘活了现有药品批文资源,提高了药品市场供给效率,还促进了中药品种的传承与发展。
3.产业聚集地:中药 B 证主要集中在安徽、河南、陕西、湖南等中医药大省。这些省份拥有丰富的中药材资源、深厚的中医药文化底蕴以及完善的中药产业体系,为中药 B 证的发展提供了良好的产业基础和环境支持,形成了具有地方特色的中药产业聚集地。
(三)生物制品(Bs):高壁垒领域
1.发展现状:2025 年新发生物制品 B 证仅 7 张,由于生物制品具有研发周期长、技术难度大、生产成本高、质量控制要求严格等特点,其审批门槛在各类药品中最高,因此市场集中度也最高,仅有少数具备较强研发实力和生产能力的企业能够进入该领域。
2.未来趋势:从产品类型来看,新发的生物制品 B 证全部为创新生物药,主要包括单抗、融合蛋白、治疗性生物制品等。这些创新生物药在治疗恶性肿瘤、自身免疫性疾病、慢性疾病等方面具有显著优势,是当前医药产业研发的热点领域。在生产模式上,由于生物制品生产工艺复杂,对生产环境和设备要求极高,委托生产方多选择专业的生物药 CDMO(合同开发生产组织)企业进行生产。CDMO 企业具备专业的生产技术、先进的生产设备和完善的质量控制体系,能够为委托方提供从药物研发到生产的全流程服务,保障创新生物药的顺利研发与生产。
3.产业聚集地:生物制品 B 证主要集中在上海市,在 7 张生物制品 B 证中,有 5 张来自上海,其余 2 张分别来自江苏和广东。上海市作为全国生物医药产业的核心城市,拥有众多国内外知名的生物医药企业、科研机构和高端人才,在生物医药研发、生产、流通等环节具有完整的产业链和强大的产业集群效应,因此成为生物制品 B 证的主要聚集地;江苏和广东则凭借自身在生物医药产业方面的一定基础和优势,也在生物制品领域取得了一定的发展。
(四)其他类型(Bq):范围拓展
2025 年,河北省核发了全国唯一一张其他类型 B 证,产品类型为医用氧。这一情况表明 MAH 制度的覆盖范围正在不断拓展,不再局限于化药、中药、生物制品等常规药品,逐步延伸到医用氧等特殊药品领域,进一步丰富了 MAH 制度的适用范围,为更多类型药品的发展提供了制度保障。
四、政策背景及影响分析
(一)132号文的深远影响
国家药监局于 2023 年发布的第 132 号公告《关于加强药品上市许可持有人委托生产监督管理工作的公告》,对我国药品生产许可证(B 证)的核发产生了深远影响,主要体现在以下两个方面:
1.审批流程调整:在 2023 年底至 2024 年期间,全国多个地区暂停了 B 证审批工作,主要是为了让地方监管部门和医药企业有足够的时间学习、理解和适应 132 号文的相关要求,同时对现有的 B 证审批流程进行重构和优化,确保审批工作更加规范、科学、高效,为后续 B 证审批工作的顺利开展奠定基础。
2.准入门槛提升:132 号文对药品上市许可持有人的资质提出了更高要求,要求持有人具备完善的质量管理体系、专业的技术人员和充足的资金实力等;同时,对受托生产企业的选择也制定了更为严格的标准,要求受托生产企业具备符合药品生产质量管理规范的生产条件、先进的生产技术和良好的质量信誉等。通过提高准入门槛,能够有效筛选出具备较强实力和良好信誉的企业参与 MAH 制度,保障药品质量安全。
(二)2025 年核发特点
2025 年全国 B 证核发呈现出 “总量控制、质量提升” 的显著特点,这一特点充分反映了 132 号文实施后,我国 MAH 制度发展达到了新的平衡状态,具体表现为:
1.审批更加审慎:监管部门在 B 证审批过程中,严格按照 132 号文的要求,对申请人的资质、质量管理体系、受托生产企业的能力等进行全面、细致的审查,审批标准更加严格,审批流程更加规范,使得 B 证核发数量从以往的高速增长逐步回归理性,避免了盲目扩张带来的风险。
2.企业责任增强:在 132 号文的要求下,医药企业的质量责任意识明显增强。企业更加重视药品质量安全,不断完善内部质量管理体系,加强对生产过程的质量控制,积极开展员工培训,提高员工的质量意识和专业水平,确保生产出的药品符合质量标准。
3.区域分化加剧:由于各地区在医药产业基础、创新能力、政策环境等方面存在差异,在 B 证核发方面呈现出明显的区域分化趋势。东部沿海发达地区凭借其雄厚的产业基础、强大的创新能力和完善的政策支持,在 B 证核发数量和质量上均处于领先地位;而中西部和东北地区由于产业基础薄弱、创新能力不足等原因,B 证核发数量相对较少,产业集聚效应进一步凸显。
五、 结论与建议
(一)结论
综合 2025 年全国药品生产许可证(B 证)核发数据及相关分析,预计未来我国 B 证核发将保持稳健、适度的节奏,不会再回到过去的高速增长状态。2025 年的 B 证核发数据,全面、客观地反映了 132 号文实施后我国 MAH 制度发展的新格局与新特征。目前,我国医药行业在 MAH 制度框架下,已从初期的探索试错阶段,正式迈入高质量、规范化发展的新周期。
从长远来看,随着后续政策的持续完善(如针对不同产品类型的细分监管细则出台)、监管手段的不断优化(如数字化追溯体系在委托生产中的全面应用),MAH 制度将进一步发挥其核心价值 —— 通过明确药品上市许可持有人的主体责任,打破 “生产与持有绑定” 的传统模式,促进研发资源、生产资源、市场资源的优化配置;同时,推动医药产业从 “规模扩张” 向 “创新驱动” 转型,为保障公众用药安全、推动我国医药产业高质量发展注入持续动力。
值得注意的是,在当前监管趋严、质量优先的背景下,MAH 获取 B 证的意义已发生本质转变:其不再是企业进入医药市场的 “入场券”,而是对药品全生命周期质量安全负责的 “责任状”。这一转变将倒逼行业整体向更规范、更专业的方向发展,加速淘汰资质不足、管理薄弱的企业,提升行业整体竞争力。
(二)建议
基于 2025 年 B 证核发特点及行业发展趋势,为推动 MAH 制度更好落地、助力企业合规发展,提出以下建议:
1.夯实质量基础,强化体系建设
药品上市许可持有人需以 132 号文要求为核心,进一步完善内部质量管理体系:建立覆盖药品研发、委托生产、流通、不良反应监测的全流程质量管控机制;定期开展质量管理体系内审与外审,及时发现并整改潜在风险;加强与受托生产企业的质量协同,明确双方在生产过程中的质量责任边界,确保药品质量可追溯、可管控。
2.审慎选择合作方,重视审计评估
受托生产企业的能力直接决定药品生产质量,持有人在选择合作方时需建立严格的筛选标准:优先考察受托企业的生产资质(如是否通过 GMP 认证、是否具备对应产品的生产经验)、质量历史(近 3 年是否存在重大质量事故或监管处罚)、技术实力(生产设备先进性、检测能力完整性);在合作前开展全面的现场质量审计,合作期间定期进行检查,避免因受托企业管理漏洞引发质量风险。
3.加强人才建设,满足合规要求
132 号文对持有人关键人员(如质量负责人、质量受权人、生产负责人等)的专业资质与履职能力提出明确要求,持有人需针对性加强人才队伍建设:引进具备医药研发、生产管理、质量管理等领域专业背景的核心人才;定期组织关键人员参加政策培训与专业技能培训,确保关键人员具备履职所需的专业能力与合规意识。
 E邀专家
E邀专家






















