 E邀专家
E邀专家
院内制剂备案制现状分析
CIO专家-墨旱莲
一、院内制剂的发展现状
1.统计数据
通过广东省药品监督管理局数据查询系统统计,截至2024年6月底,广州市医疗机构共拥有1112个制剂品种,其中中药制剂品种828个,占比74.46%,但市属医疗机构的中药制剂品种仅116个,占比14%。
根据穗府信息专送2024年第259 期可见,2023年 广州市院内制剂销售总金额近5.2亿元,销售金额超100万的制剂品种有 109 个。 目前,广州市医疗机构正 在积极研发的制剂品种近 200 个,其中中药制剂占比近 90%。

(刘若轩,余馨怡,谢晓琳,等. 院内制剂产业现状与未来趋势分析 [J]. 现代医院, 2025, 25 (04): 541-544+548.)
2.经济利益
南通市首家县级市三级甲等中医医院的院内制剂销售数据为例进行分析,在2020-2023年期间,中药制剂的销售金额中间有小幅下降但整体为上升趋势,而化药整体销售额呈平稳趋势。平均单个制剂的年销售金额,中药制剂也远超过西药制剂的3~5倍,由此可见在院内制剂的销售额度中,中药制剂占据比西药制剂更重要的比重,也是在药品零加成政策下,医院药剂科盘活科室运转重要发展方向。
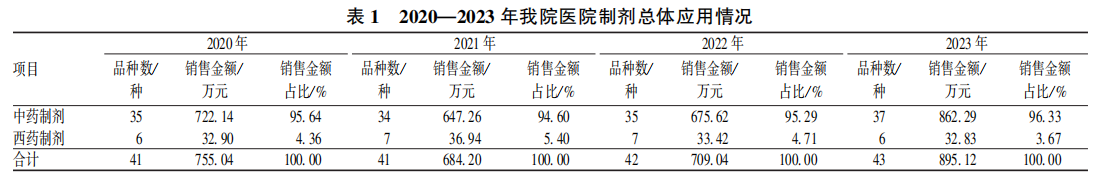
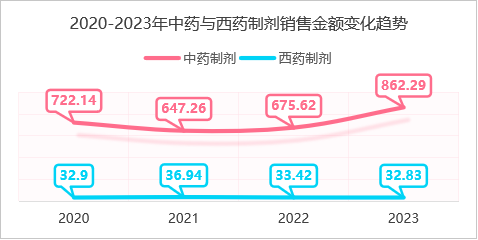
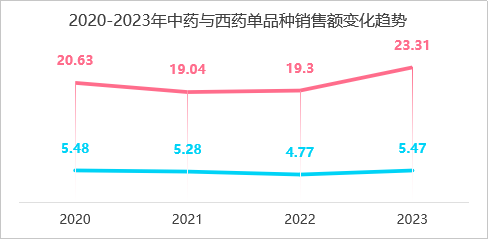
何春慧,程峰,李万红. 某中医医院院内中药制剂应用现状及发展趋势分析 [J]. 中国医院用药评价与分析, 2024, 24 (11): 1386-1388+1393. DOI:10.14009/j.issn.1672-2124.2024.11.020.
3.发展前景
院内复方中药制剂目前是1类中药新药的重要研发来源,事实上,市场上很多耳熟能详的中药品种都来源于医疗机构制剂转化,如复方丹参滴丸、急 支糖浆等。越来越多的企业加大布局院内制剂转化。如丽珠医药重点围绕中医的优势病种,布局 医疗机构中药制剂向 1.1 类创新药转化;珍宝岛有 3 个院内制剂注册项目完成药学、毒理研究及 药效学研究,正在着手申报临床研究。
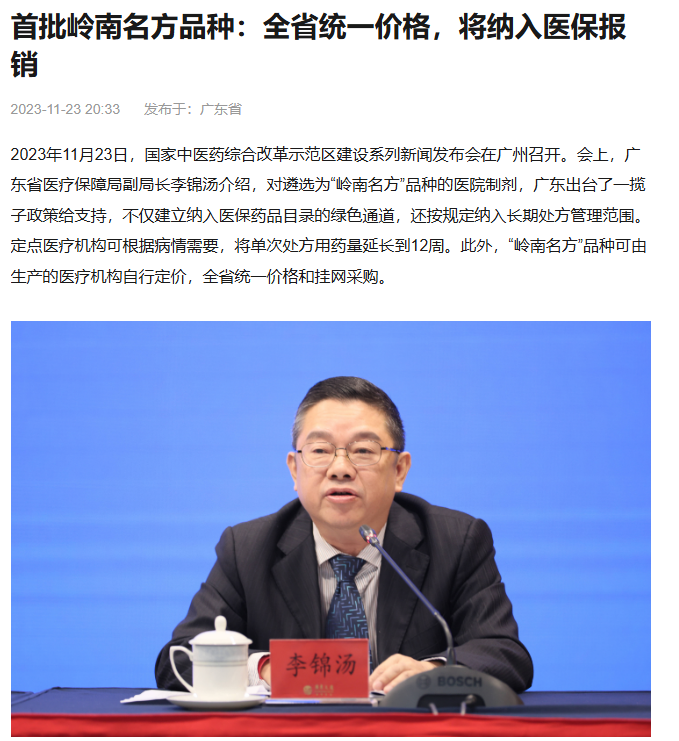
随着2018年国家食品药品监督管理颁布医疗机构制剂备案制政策以来,各省药品监督管理局分别出台了院内制注册备案制细则,鼓励医疗机构院内制剂的为了促进医院院内制剂的发展,广东食品药品监督管理局联合广东省医疗保障局,分别开展岭南名方遴选活动、建立院内制剂纳入医保目录的绿色路径、岭南名方目录内院内制剂可以统一定价全省挂网销售、岭南名方目录产品进入港澳销售,逐步辐射东南亚市场等措施,全面加快医疗机构机制的研发投产转化。
(刘鹤.院内瑰宝,向“新”发力挖掘院内中药制剂“孵化器”潜力[EB/OL].(2024-04-30).https://m.cnpharm.com/c/2024-04-30/1043908.shtml(2025-07-28).)


二、院内制剂注册与备案的区别
1.备案与注册在工艺上区别
中药制剂备案制通常用于配置工艺与传统工艺基本一致的制剂,只是中药饮片经粉碎或仅经水提取制成的固体、半固体和液体传统剂型、现代剂型等。可见,注册制和备案制的使用对象的区别在于,注册制针对化药和非传统制备工艺的中药制剂及中药的特殊剂型,非传统工艺常见于挥发油的提取、水提醇沉等,中药复方制剂中的片剂等未纳入备案制的剂型也要使用注册制。需要注意的是,如果使用了醇提后浓缩,由于浓缩工艺容易溶剂残留,存在一定的质量安全隐患,使用该路径制备药物不能作为医疗机构制剂进行注册或者备案。
2.院内制剂备案制的应用制剂品种的区别
国家食品药品监督管理局颁布的院内制剂备案制文件中指出备案制适用范围为由中药饮片经粉碎或仅经水或油提取制成的固体、半固体和液体传统剂型;由中药饮片经水提取制成的颗粒剂及以由中药饮片粉碎后制成的胶囊剂;由中药饮片用传统方法制成的酒剂、酊剂。随之各个省食品药品监督管理局结合本省中医药特色及院内制剂管理的实际需求,对备案制适用范围进行了进一步的修改和迭代。例如青海西藏等具有少数民族特色加上了民族药材和藏药,辽宁和新疆将备案制的使用剂型进行了具体的罗列,青海四川西藏等省也对药理药效实验的豁免条件进行了对应的修改和说明
表2各省份备案适用范围的对比情况
规定来源 | 备案适用范围 |
《公告》 | 由中药饮片经粉碎或仅经水或油提取制成的固体、半固体和液体传统剂型;由中药饮片经水提取制成的颗粒剂以及由中药 饮片经粉碎后制成的胶囊剂;由中药饮片用传统方法提取制成的酒剂、酊剂” |
青海西藏 | 参考了《公告》的传统备案范围外,增加了“中药民族药材或其饮片用少数民族传统方法制成的民族药传统剂型” 参考了《公告》的传统备案范围外,增加了“藏医临床使用的其他特色剂型” |
辽宁 | 对《公告》的第一项进行了细化,明确列举出传统中药制剂的剂型:由中药饮片经粉碎或仅经水或油提取制成的丸剂(包括 蜜丸、水蜜丸、水丸、糊丸、蜡丸、浓缩丸等)、散剂、丹剂、锭剂、茶剂、煎膏剂(膏滋)、膏药、胶剂、浸膏剂、流浸膏剂、糊剂、汤 剂、合剂、口服液剂、糖浆剂、搽剂、洗剂等传统剂型 |
新疆 | 对《公告》的第一项进行了细化,明确列举出传统中药制剂的剂型:由中药饮片经粉碎或仅经水或油提取制成的丸剂(包括 蜜丸、水蜜丸、水丸、糊丸、蜡丸、浓缩丸等)、散剂、丹剂、锭剂、栓剂、茶剂、煎膏剂(膏滋)、蜜膏剂、糖膏剂、膏药、胶剂、浸膏 剂、流浸膏剂、糊剂、汤剂、合剂、糖浆剂、露剂、搽剂、洗剂等传统剂型 |
表3各省份豁免条件的对比情况
规定来源 | 豁免条件 |
《公告》 | 处方在本医疗机构已有5年或以上的使用历史,可免除提交主要药效学、单次和多次给药毒性试验的资料及相关文献 |
青海 | 参考了《公告》的豁免条件外,增加了对于国家和省级名医的固定处方以及古代经典名方,若使用传统工艺配制并在临床 上应用3年或以上 |
四川 | 参考了《公告》的豁免条件外,增加了对国家药监局认定的“古代经典名方目录”中的方剂,以及省药监局收录的医疗机构 制剂规范品种 |
西藏 | 参考了《公告》的豁免条件外,增加了对于使用传统工艺配制的藏药制剂,是古代经典名方且能提供处方出处 |
三、院内制剂备案制流程
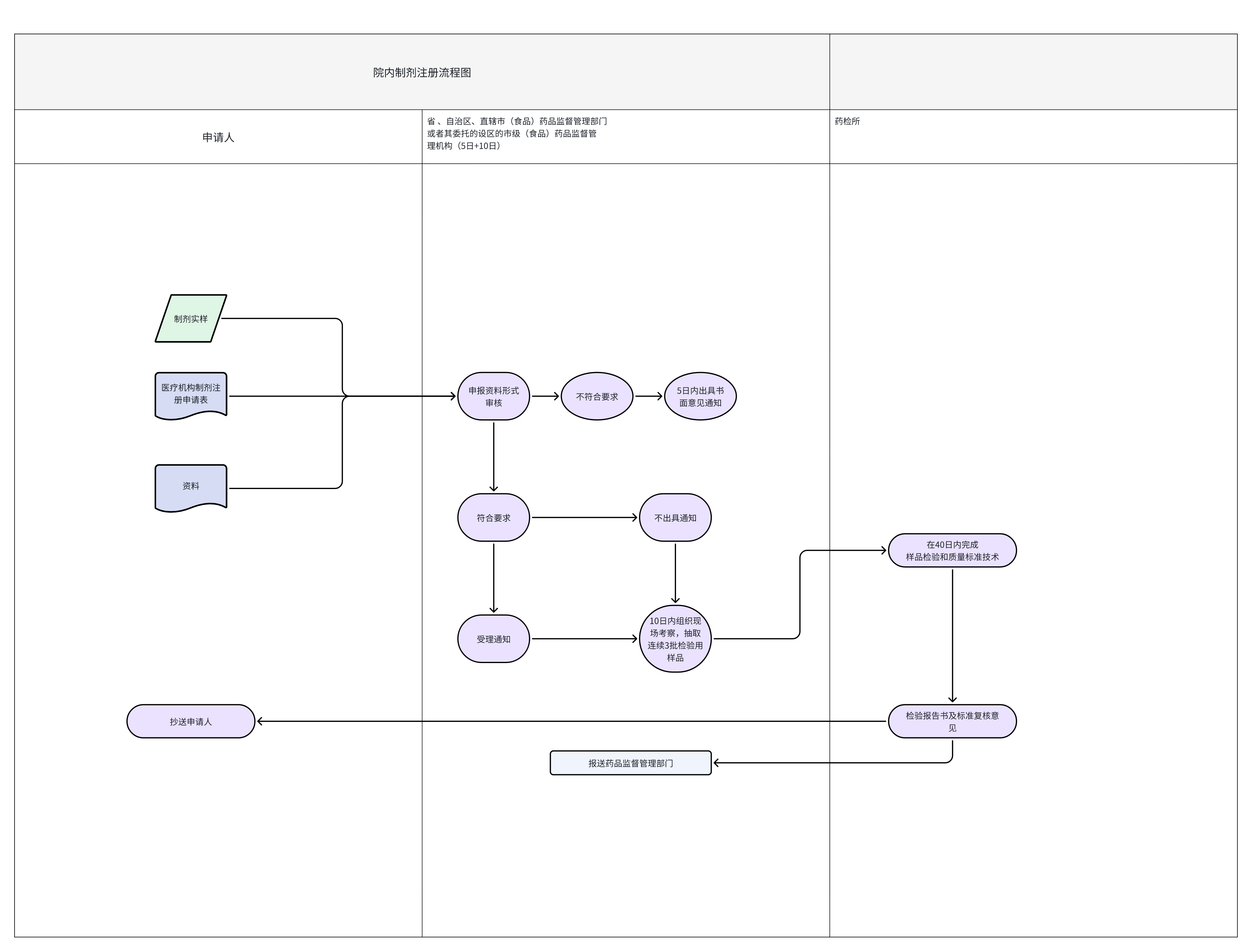
1.备案制的主要管理部门及申报流程
通常院内制剂备案制主要的管理部门有三个,他们分别负责模块如下表所示,备案申报的具体流程如下流程图所示。
部门 | 职责 |
广东省药品监督管理局 | 许可、备案和监督管理 |
广东省药品检验所 | 注册检验 |
广东省药监局审评认证中心 | 技术审评与核查 |
2.不同备案制的申报资料区别
以广东省为例,院内制剂备案制申报资料如下表所示通常分为16个模块,其中第14-16个模块根据临床使用历史数据可进行申请豁免。临床使用5年及以上,无毒性药材,无十八反十九畏配伍,可以免除14-16。临床使用5年及以上,但是处方中含有“剧毒”“大毒”及现代药理学证明有毒性的药材,或者十八反十九畏药味时,可免除14药效学实验,但是15-16单次给药毒性及重复给药毒性试验不能免除。
并且临床使用经验资料要求:1.临床连续使用5年及以上;2. 不低于100例及以上相对完整临床使用病历,每年不得少于10例,同时病历的临床处方中君臣药不能变更,佐使药物可以根据患者需求进行变更,但是总变更例数不得超过10例。
3.临床人用经验及相关数据分析--中药复方院内制剂的临床人用经验及新药开发的药效学支持数据
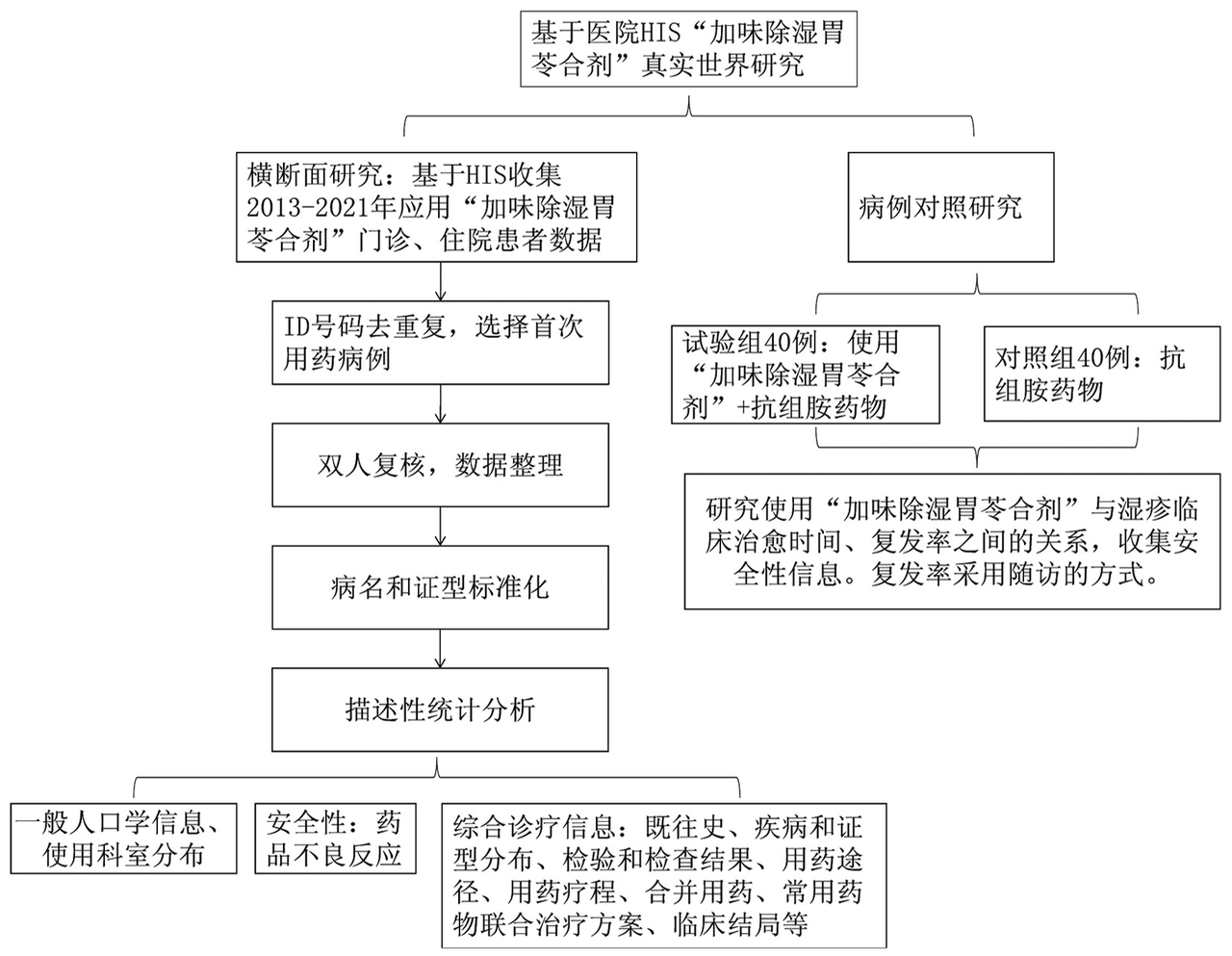
医疗机构进行人用经验数据整理时,通常从HIS/EMR数据中抽取药品进销存,成本和收益分析,获取临床用量较大,历史临床用协方和验方使用数据,药品有效性,药品安全性等数据评估其开发为院内制剂的技术、安全性、经济收益等信息。也可在该步骤进行真实研究数据的抽取和分析,作为院内制剂向中药新药转化的数据支持,有可能能够豁免二期临床实验,降低研发成本。目前市场已经大数据研究方向的科研单位正在针对中医医药临床数据进行嵌入算法的软件研发,并推广给药品研发机构进行使用。如下图所示,在HIS/MER系统中抽取的数据进行数据的整理,清洗,治理后获取标准化的临床数据,可使用分析软件进行统计分析,从而支持真实世界研究、院内制剂新药转化等新药研发步骤。
四、备案制申请资料常见问题
院内制剂备案制资料常见的不合问题有辅料筛选,用量比例,防腐或者抑菌剂的使用剂量不合理等。例如在制备颗粒剂时,使用干法制粒时,辅料用量不得超过干膏用量的2倍,湿法制粒时辅料用量不得超过清膏的5倍。而在合剂或口服液中使用防腐剂时,通常要求羟苯酯类、苯甲酸的用量分别不超过0.05%、0.3%并需要在处方确定时开展抑菌效力试验研究。
一般情况下,备案制院内制剂的适用症范围要和人用经验数据中所覆盖的适应症保持一致。部分的申报资料存在申报品种的适用症设计依据不足或者用药人群扩大化,例如儿童感冒药退热颗粒剂申报时用药涵盖对象为1~12岁,而提供的人用经验数据仅覆盖了6~12岁。外用洗剂申报时的主治范围为湿疹、癣、疥疮及虫咬皮疹,而该处方的临床应用经验数据中并无“疥疮”的主治历史。
在稳定性研究中,稳定性考察的数据0月数据必须为中试样品制备后当月内完成,也就是要求中试药品的质量标准必须要在0月内完成,否则稳定考察数据不合理。采用半透明容器的液体制剂,例如使用低密度聚乙烯制备的透明容器,在稳定性考察时,还要增加低湿稳定性试验。
五、院内制剂的生产及委托生产
中药制剂(如传统工艺配制的膏方、丸剂等)若符合《关于对医疗机构应用传统工艺配制中药制剂实施备案管理的公告》(2018年第19号),可委托具有《药品生产许可证》且通过GMP认证的企业生产受托方需具备相应剂型生产资质,且委托方需提供配方和原料,全程监督质量。委托生产的中药制剂需向省级药监局备案,取得备案号后合法配制,备案号与批准文号等效。并且接受省食品药品监督管理局的现场核查和不定期抽验监督。
 E邀专家
E邀专家






















